
【题目】下列混合物都能用分液漏斗分离,其油层从分液漏斗下口流出的是( )
A.食用油和水B.汽油和水
C.四氯化碳和水D.苯和水
科目:高中化学 来源: 题型:
【题目】下列关于自然界中氮循环(如图)的说法不正确的是( )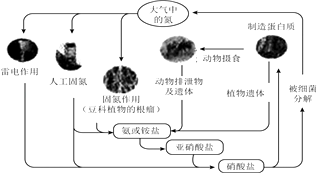
A.氮元素均被氧化
B.工业合成氨属于人工固氮
C.含氮无机物和含氮有机物可相互转化
D.碳、氢、氧三种元素也参加了氮循环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中正确的是( )
A.用规格为10 mL的量筒量取6.20 mL的液体
B.蒸发结晶时,可将溶液直接蒸干
C.利用蒸馏或分馏可除去液态混合物中沸点不同的易挥发、难挥发或不挥发的杂质
D.用四氯化碳萃取碘水中的碘,充分静置后紫红色液体在上层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中正确的是
A.配制一定物质的量浓度的硫酸溶液时,用量筒量取一定体积的浓硫酸倒入烧杯后,再用蒸馏水洗涤量筒2~3次,并将洗涤液一并倒入烧杯中稀释
B.玻璃导管蘸水后,边旋转边向橡皮管中插入
C.用胶头滴管向试管中加入液体时,为防止滴在试管外面,应将滴管尖嘴处伸入试管口中
D.称量氢氧化钠固体的质量时,将称量物放在纸片上,并置于托盘天平的左盘,砝码放在托盘天平的右盘。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.在100℃、101kPa条件下,液态水的气化热为40.69kJmol﹣1 , 则H2O(g)H2O(l)的△H=40.69kJmol﹣1
B.常温下,在0.10molL﹣1的NH3H2O溶液中加入少量NH4Cl晶体,能使NH3H2O的电离度降低,溶液的pH减小
C.已知:
共价键 | C﹣C | C=C | C﹣H | H﹣H |
键能/kJmol﹣1 | 348 | 610 | 413 | 436 |
则反应 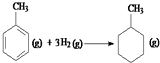 的焓变为△H=[(4×348+3×610+8×413)+3×436﹣(7×348+14×413)]kJmol﹣1=﹣384kJmol﹣1
的焓变为△H=[(4×348+3×610+8×413)+3×436﹣(7×348+14×413)]kJmol﹣1=﹣384kJmol﹣1
D.已知MgCO3的Ksp=6.82×10﹣6 , 则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32﹣),且c(Mg2+)c(CO32﹣)=6.82×10﹣6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知K、Ka、KW、Ksp分别表示化学平衡常数、弱酸的电离平衡常数、水的离子积常数、难溶电解质的溶度积常数.
(1)有关上述常数的说法正确的是 .
a.它们都能反映一定条件下对应变化进行的程度
b.它们的大小都随温度的升高而增大
c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
(2)25℃时将a molL﹣1的氨水与0.01molL﹣1的盐酸等体积混合所得溶液中c(NH4+)=c(Cl﹣),则溶液显(填“酸”、“碱”或“中”)性;用含a的代数式表示NH3H2O的电离平衡常数Kb=
(3)已知25℃时CH3COOH和NH3 . H2O电离常数相等,则该温度下CH3COONH4溶液中水电离的H+浓度为 , 溶液中离子浓度大小关系为
(4)25℃时,H2SO3═HSO3﹣+H+的电离常数Ka=1×10﹣2molL﹣1 , 则该温度下pH=3、c(HSO3﹣)=0.1molL﹣1的NaHSO3溶液中c(H2SO3)= .
(5)已知常温下Fe(OH)3和Mg(OH)2的Ksp分别为8.0×10﹣38、1.0×10﹣11 , 向浓度均为0.1mol/L的FeCl3、MgCl2的混合溶液中加入碱液,要使Fe3+完全沉淀而Mg2+不沉淀,应该调节溶液pH的范围是 . (已知lg 2=0.3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的量浓度表述正确的是( )
A. 98%的H2SO4物质的量浓度为18.4mol/L ,则49%的H2SO4物质的量浓度为9.2mol/L
B. 当2L水吸收44.8L氨气(标况)时所得氨水的浓度不是1molL-1,只有当44.8L(标况)氨气溶于水制得2L氨水时,其浓度才是1molL-1
C. 只含K2SO4和NaCl的混合水溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定相同
D. 50mL 1mol/L的AlCl3溶液中的Cl—浓度与50ml 3mol/L的BaCl2溶液Cl—浓度相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com