
【题目】已知K、Ka、KW、Ksp分别表示化学平衡常数、弱酸的电离平衡常数、水的离子积常数、难溶电解质的溶度积常数.
(1)有关上述常数的说法正确的是 .
a.它们都能反映一定条件下对应变化进行的程度
b.它们的大小都随温度的升高而增大
c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
(2)25℃时将a molL﹣1的氨水与0.01molL﹣1的盐酸等体积混合所得溶液中c(NH4+)=c(Cl﹣),则溶液显(填“酸”、“碱”或“中”)性;用含a的代数式表示NH3H2O的电离平衡常数Kb=
(3)已知25℃时CH3COOH和NH3 . H2O电离常数相等,则该温度下CH3COONH4溶液中水电离的H+浓度为 , 溶液中离子浓度大小关系为
(4)25℃时,H2SO3═HSO3﹣+H+的电离常数Ka=1×10﹣2molL﹣1 , 则该温度下pH=3、c(HSO3﹣)=0.1molL﹣1的NaHSO3溶液中c(H2SO3)= .
(5)已知常温下Fe(OH)3和Mg(OH)2的Ksp分别为8.0×10﹣38、1.0×10﹣11 , 向浓度均为0.1mol/L的FeCl3、MgCl2的混合溶液中加入碱液,要使Fe3+完全沉淀而Mg2+不沉淀,应该调节溶液pH的范围是 . (已知lg 2=0.3)
【答案】
(1)a
(2)中,![]()
(3)1.0×10﹣7mol/L,c(NH4+)═c(CH3COO﹣)>c(OH﹣)═c(H+)
(4)0.01mol/L
(5)3.3≤pH<9
【解析】解:(1)a.平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比,所以它们都能反映一定条件下对应变化进行的程度,故正确;
b.升高温度平衡向吸热方向移动,如果化学平衡正反应是放热反应,则升高温度化学平衡常数减小,故错误;
c.电离平衡常数只与温度有关,温度相同电离平衡常数相同,故错误;
故选a;
(2)所得混合溶液中c(NH4+)=c(Cl﹣),根据电荷守恒得c(OH﹣ )═c(H+),溶液呈中性;根据物料守恒得c(NH3.H2O)=(0.5a﹣0.005)mol/L,根据电荷守恒得c(H+)=c(OH﹣)=10﹣7mol/L,溶液呈中性,NH3H2O的电离常数Kb= ![]() =
= ![]() =
= ![]() ,
,
所以答案是:中; ![]() ;
;
(3)CH3COOH和NH3.H2O电离常数相等,则该温度下CH3COONH4溶液铵根离子和醋酸根离子水解程度相同,导致醋酸铵溶液呈中性,水电离出的氢离子浓度为1.0×10﹣7mol/L;水的电离程度很小,溶液中离子浓度大小顺序是c(NH4+)═c(CH3COO﹣)>c(OH﹣ )═c(H+),所以答案是:1.0×10﹣7mol/L;c(NH4+)═c(CH3COO﹣)>c(OH﹣ )═c(H+);
(4)电离常数Ka=1×10﹣2molL﹣1,则该温度下pH=3、c(HSO3﹣)=0.1molL﹣1的NaHSO3溶液中c(H2SO3)= ![]() =
= ![]() mol/L=0.01 mol/L,
mol/L=0.01 mol/L,
所以答案是:0.01 mol/L;
(5) ![]() ≤c(OH﹣ )<
≤c(OH﹣ )< ![]() ,
, ![]() mol/L≤c(OH﹣ )<
mol/L≤c(OH﹣ )< ![]() mol/L,2×10﹣13×
mol/L,2×10﹣13× ![]() mol/L≤c(OH﹣ )<1×10﹣5mol/L,
mol/L≤c(OH﹣ )<1×10﹣5mol/L, ![]() mol/L<c(H+)≤
mol/L<c(H+)≤ ![]() mol/L,则3.3≤pH<9,
mol/L,则3.3≤pH<9,
所以答案是:3.3≤pH<9.
【考点精析】通过灵活运用化学平衡状态本质及特征和弱电解质在水溶液中的电离平衡,掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理即可以解答此题.


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案科目:高中化学 来源: 题型:
【题目】下面试剂瓶中盛放的是某同学配制的硫酸亚铁溶液,请回答下列问题:

(1)配制该FeSO4溶液需用到这种仪器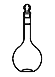 ,该仪器名称是____________;若配制500 mL该FeSO4溶液,则需要称量FeSO4固体_______g。
,该仪器名称是____________;若配制500 mL该FeSO4溶液,则需要称量FeSO4固体_______g。
(2)该同学取所配制的FeSO4溶液放于四支试管中(标号分别为①②③④),分别进行了如下实验,请按要求填写相应内容:
①号试管观察溶液颜色是__________色。
②号试管加入NaOH溶液时,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色,写出这一过程中反应的化学方程式:____________;________________。
③号试管加入少量KSCN溶液,如果溶液变成红色,说明该溶液已变质,溶液中含有_____;可在变红的溶液中加入少量铁粉振荡,红色消失,其离子方程式为__________。
④号试管加入少量氯水,反应的离子方程式为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于合理饮食有利于健康的下列说法正确的是( )
A.没有水就没有生命
B.饮用水越纯净越好
C.养成良好的饮食习惯,只吃蔬菜,水果等碱性食物
D.调味剂和营养剂加的越多越好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1体积某气态烃和2体积氯化氢发生加成反应后,最多还能和6体积氯气发生取代反应.由此可以断定原气态烃是(气体体积均在相同条件下测定)( )
A.乙炔
B.丙炔
C.丁炔
D.丁二烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物 A 的结构简式如图,下列有关 A 的性质叙述中,错误的是( ) 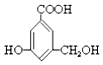
A.A 与金属钠完全反应时,两者物质的量之比为 1:3
B.A 与氢氧化钠完全反应时,两者物质的量之比为 1:1
C.A 能与碳酸钠溶液反应
D.A 既能与羧酸反应,又能与醇反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A中含有KAl(SO4)2、Al2O3和Fe,在一定条件下可实现如图所示的物质之间的转化:
据此判断:
(1)固体B的化学式为________________,其归属的物质类别是:________________。
(2)固体E所含物质的化学式为________________。
(3)写出反应①的化学方程式:_______________________________。
(4)写出反应②的离子方程式:______________________________。
(5)某化学反应产物为Al2O3和Fe,此反应的名称是_________,化学方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH2OH(羟胺)是一种无色针状结晶,羟胺及其盐类常用作有机合成的还原剂。回答下列问题:
(1)NH2OH的电子式为。
(2)拉西法制备羟胺的总反应为2NO2-+4SO2+6H2O+6NH3=4SO42-+6NH4++2NH2OH。该反应中NH3(填“作氧化剂”“作还原剂”或“既不作氧化剂又不作还原剂”)。
(3)室温时,NH2OH会发生分解反应,分解产生的无色气体遇浓盐酸产生白烟,与空气接触变为红棕色;且其分解产物会使无水CuSO4变蓝色,则NH2OH分解反应的化学方程式为。
(4)催化还原NO是制备盐酸羟胺的一种方法,其反应原理如下:2NO+3H2+2HCl ![]() 2NH2OH·HCl,某校合作学习小组的同学设计了如图所示装置制备盐酸羟胺:
2NH2OH·HCl,某校合作学习小组的同学设计了如图所示装置制备盐酸羟胺: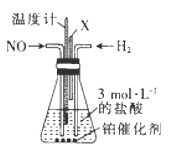
①该实验适宜的加热方式为。
②装置中导管X的作用是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PbO2、KMnO4、Cl2、FeCl3、CuCl2的氧化性依次减弱。下列反应不可能发生的是
A. Cu+2Fe3+==Cu2++2Fe2+ B. 10Cl-+2MnO![]() +16H+=2Mn2++5Cl2↑+8H2O
+16H+=2Mn2++5Cl2↑+8H2O
C. Cu+Cl2![]() CuCl2 D. 5Pb2++2MnO
CuCl2 D. 5Pb2++2MnO![]() +2H2O=5PbO2↓+2Mn2++4H+
+2H2O=5PbO2↓+2Mn2++4H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com