
【题目】某同学用含结晶水的正盐X(四种短周期元素组成的纯净物)进行了如下实验:

实验中观测到:混合气甲呈无色并被蒸馏水全部吸收;固体乙为纯净物;在步骤③中,取1/10溶液丙,恰好中和需消耗0.00200molNaOH;另取一定量的溶液丙,加入少量K2FeO4固体,产生黄绿色气体。
请回答:
(1)X的化学式是__________,步骤①的化学方程式是______________________________。
(2)溶液丙与K2FeO4固体反应的化学方程式是_____________________________________。
【答案】MgCl2·6H2O MgCl2·6H2O![]() MgO+2HC1↑+5H2O↑ 2K2FeO4+16HC1=4KCl+2FeCl3+3Cl2↑+8H2O
MgO+2HC1↑+5H2O↑ 2K2FeO4+16HC1=4KCl+2FeCl3+3Cl2↑+8H2O
【解析】
据题意知,含结晶水的正盐X共含有四种短周期元素,经灼烧所得的混合气体中含有水蒸气,混合气甲经步骤②、③、④得白色沉淀,可判断混合气甲中有氯元素,由混合气甲呈无色并被蒸馏水全部吸收,且溶液丙可以被NaOH溶液中和、与少量K2FeO4反应能生成黄绿色气体,可得混合气体甲中含有HCl气体。结合正盐X灼烧得到混合气体甲和固体乙可推知X含有H、O、Cl和一种金属元素。
依题意经计算可知混合气体甲中:n(HCl)=0.02mol,n(H2O)=![]() mol=0.05mol。
mol=0.05mol。
又因盐X为正盐,并且所含元素均为短周期元素,可知其阴离子为氯离子,阳离子可能为Na+、Mg2+或Al3+。若是钠离子,则X灼烧时无法产生HCl气体,不符合题意,而氯化镁晶体和氯化铝晶体灼烧后得到的分别是氧化酶和氧化铝,根据固体乙的质量计算可知阳离子为Mg2+,固体乙为MgO,n(MgO)-0.01mol,故X为MgCl2·6H2O,据此解答。
据题意知,含结晶水的正盐X共含有四种短周期元素,经灼烧所得的混合气体中含有水蒸气,混合气甲经步骤②、③、④得白色沉淀,可判断混合气甲中有氯元素,由混合气甲呈无色并被蒸馏水全部吸收,且溶液丙可以被NaOH溶液中和、与少量K2FeO4反应能生成黄绿色气体,可得混合气体甲中含有HCl气体。结合正盐X灼烧得到混合气体甲和固体乙可推知X含有H、O、Cl和一种金属元素。
依题意经计算可知混合气体甲中:n(HCl)=0.02mol,n(H2O)=![]() mol=0.05mol。
mol=0.05mol。
又因盐X为正盐,并且所含元素均为短周期元素,可知其阴离子为氯离子,阳离子可能为Na+、Mg2+或Al3+。若是钠离子,则X灼烧时无法产生HCl气体,不符合题意,而氯化镁晶体和氯化铝晶体灼烧后得到的分别是氧化酶和氧化铝,根据固体乙的质量计算可知阳离子为Mg2+,固体乙为MgO,n(MgO)-0.01mol,故X为MgCl2·6H2O,
(1)由分析可知X的化学式为MgCl2·6H2O,其灼烧时分解生成MgO、HCl和H2O,发生反应的化学方程式为:MgCl2·6H2O![]() MgO+2HC1↑+5H2O↑。
MgO+2HC1↑+5H2O↑。
(2)溶液丙为稀盐酸,加入少量K2FeO4固体,产生黄绿色气体为Cl2,可知此反应发生氧化还原反应,还原产物应为FeCl3,根据电子守恒和原子守恒可知发生反应的化学方程式为:2K2FeO4+16HC1=4KCl+2FeCl3+3Cl2↑+8H2O。


科目:高中化学 来源: 题型:
【题目】在铜、锌、稀硫酸构成的原电池中(如图所示)
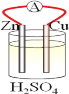
(1)负极是__________(填“铜”或“锌”),_________电子(填“失去”或“得到”),发__________(填“氧化”或 “还原”),电极反应方程式______________;
(2)电流由__________流向__________(填“铜”或“锌),铜片上观察到的现象是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图, 水槽中试管内有一枚铁钉,放置数天观察:
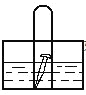
(1)若液面上升,则溶液呈______性,发生______腐蚀,电极反应式为:负极:______________,正极:___________________。
(2)若液面下降,则溶液呈________性,发生_________腐蚀,电极反应式为:负极:______________;正极:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)![]() N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是()
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是()
A | B | C | D |
|
|
|
|
升高温度,正反应方向平衡常数减小 | 0~3s内,反应速率为:v(NO2)=0.2 mol·L-1·s-1 | t1时仅加入催化剂,平衡正向移动 | 达平衡时,仅改变x,则x为c(O2) |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。下列方法中,可以使醋酸溶液中CH3COOH电离程度增大的是_______。
A. 滴加少量浓盐酸 B. 微热溶液 C. 加水稀释 D. 加入少量醋酸钠晶体
(2)用0.1mol·L-1NaOH溶液分别滴定体积均为 20mL、浓度均为0.1mol·L-1的盐酸和醋酸溶液, 得到滴定过程中溶液 pH 随加入 NaOH 溶液体积而变化的两条滴定曲线。
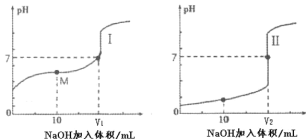
①滴定醋酸的曲线是_______(填“I”或“II”)。
②图I中 V=10 时,溶液中的c(Na+)________c(A-)。(填“>”、“=”或“<”,其中A-代表酸根离子)
(3)下表为某同学所测 25℃时,甲、乙两种溶液的 pH。
甲 | 乙 | |
pH | 11 | 11 |
溶液 | 氨水 | 氢氧化钠溶液 |
①甲溶液中的c(OH-) =_________mol/L。
②25℃时,等体积的甲、乙两溶液与等浓度的盐酸恰好完全反应,消耗的盐酸体积:甲_______乙。(填“>”、“=”或“<”)
③甲、乙溶液均加水稀释 10 倍后,所得溶液的 pH:甲______乙。(填“>”、“=”或“<”)
(4)下表是几种常见弱酸的电离常数
化学式 | CH3COOH | H2SO3 | HClO | H2CO3 |
电离常数 | 1.8×10-5 | K1=1.23×10-2 K2=6.6×10-8 | 3.0×10-8 | K1=4.4×10-7 K2=4.7×10-11 |
以下反应对应的离子方程式正确的是_______。
A.Na2CO3溶液吸收少量SO2:![]() +SO2+H2
+SO2+H2![]() +
+![]()
B.漂白液生效的原理:ClO-+CO2+H2O = HClO+![]()
C.次氯酸钠溶液吸收少量SO2:ClO-+SO2+H2O = HClO+![]()
D.醋酸除水垢中的CaCO3:2CH3COOH+CaCO3= Ca2++2CH3COO-+H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,不正确的是

A. 正极电极反应式为:2H++2e—→H2↑
B. 此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3
C. 此过程中铜并不被腐蚀
D. 此过程中电子从Fe移向Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示。下列说法正确的是( )

A.化合物RX中含共价键
B.化合物X2M是非电解质
C.M的单质在常温常压下为气体
D.Y形成的化合物种类最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有Na+、K+、NH4+、Ca2+、Cu2+、SO42—、SO32—、Cl-、Br-、CO32—中的若干种,离子浓度都为0.1 mol·L-1。往该溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成。某同学另取少量原溶液,设计并完成如图所示实验。则下列关于原溶液的判断正确的是( )
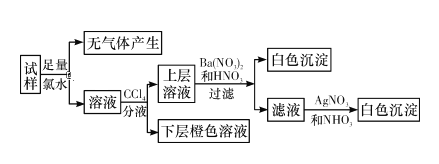
A.若实验中Ba(NO3)2和HNO3的混合溶液改用BaCl2和盐酸的混合溶液,对溶液中离子的判断无影响
B.无法确定原溶液中是否存在Cl-
C.原溶液中肯定存在的上述离子是SO32—、Br-,是否存在Na+、K+需要通过焰色反应来确定
D.原溶液中肯定不存在的上述离子是Ca2+、Cu2+、SO42—、CO32—,是否存在NH4+另需实验验证
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下图所示的原电池,下列说法正确的是( )
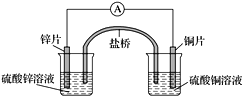
A. 电子从锌电极通过电流表流向铜电极
B. 盐桥中的阴离子向硫酸铜溶液中迁移
C. 铜电极发生还原反应,其电极反应是2H++2e-===H2↑
D. 取出盐桥后,电流表仍会偏转,铜电极在反应前后质量不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com