
【题目】弱电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。下列方法中,可以使醋酸溶液中CH3COOH电离程度增大的是_______。
A. 滴加少量浓盐酸 B. 微热溶液 C. 加水稀释 D. 加入少量醋酸钠晶体
(2)用0.1mol·L-1NaOH溶液分别滴定体积均为 20mL、浓度均为0.1mol·L-1的盐酸和醋酸溶液, 得到滴定过程中溶液 pH 随加入 NaOH 溶液体积而变化的两条滴定曲线。
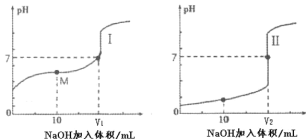
①滴定醋酸的曲线是_______(填“I”或“II”)。
②图I中 V=10 时,溶液中的c(Na+)________c(A-)。(填“>”、“=”或“<”,其中A-代表酸根离子)
(3)下表为某同学所测 25℃时,甲、乙两种溶液的 pH。
甲 | 乙 | |
pH | 11 | 11 |
溶液 | 氨水 | 氢氧化钠溶液 |
①甲溶液中的c(OH-) =_________mol/L。
②25℃时,等体积的甲、乙两溶液与等浓度的盐酸恰好完全反应,消耗的盐酸体积:甲_______乙。(填“>”、“=”或“<”)
③甲、乙溶液均加水稀释 10 倍后,所得溶液的 pH:甲______乙。(填“>”、“=”或“<”)
(4)下表是几种常见弱酸的电离常数
化学式 | CH3COOH | H2SO3 | HClO | H2CO3 |
电离常数 | 1.8×10-5 | K1=1.23×10-2 K2=6.6×10-8 | 3.0×10-8 | K1=4.4×10-7 K2=4.7×10-11 |
以下反应对应的离子方程式正确的是_______。
A.Na2CO3溶液吸收少量SO2:![]() +SO2+H2
+SO2+H2![]() +
+![]()
B.漂白液生效的原理:ClO-+CO2+H2O = HClO+![]()
C.次氯酸钠溶液吸收少量SO2:ClO-+SO2+H2O = HClO+![]()
D.醋酸除水垢中的CaCO3:2CH3COOH+CaCO3= Ca2++2CH3COO-+H2O+CO2↑
【答案】BC I < 0.001 > > BD
【解析】
(1)A. 滴加少量浓盐酸,增大了氢离子的浓度,平衡左移,CH3COOH电离程度减小;
B. 微热溶液,促进醋酸电离,CH3COOH电离程度增大;
C. 加水稀释,促进醋酸电离,CH3COOH电离程度增大;
D .加入少量醋酸钠晶体,增大了醋酸根离子浓度,平衡左移,CH3COOH电离程度减小;
(2)①盐酸是强酸、醋酸是弱酸,0.1 mol·L-1的盐酸中c(H+)=0.1mol/L,0.1 mol·L-1醋酸中c(H+)<0.1mol/L,所以盐酸的pH=1,醋酸的pH>1;
②图I中,V=10时,pH<7,所以c(H+)>c(OH-),根据电荷守恒c(H+)+c(Na+)=c(OH-)+c(CH3COO-),故c(Na+)<c(CH3COO-);
(3)①甲溶液的pH =11,c(H+)=10-11ol/L,c(OH-) =10-3mol/L;
②由于氨水是弱碱,c(NH3H2O) >10-3mol/L,c(NaOH) =10-3mol/L;
③由于氨水是弱碱,稀释过程中电离程度增大,n(OH-)增大;NaOH是强碱;
(4)根据表格提供的数据和强酸制弱酸的原理分析可得。
(1)A. 滴加少量浓盐酸,增大了氢离子的浓度,平衡左移,CH3COOH电离程度减小,选项A错误;
B. 微热溶液,促进醋酸电离,CH3COOH电离程度增大,选项B正确;
C. 加水稀释,促进醋酸电离,CH3COOH电离程度增大,选项C正确;
D .加入少量醋酸钠晶体,增大了醋酸根离子浓度,平衡左移,CH3COOH电离程度减小,选项D错误;
答案选BC;
(2)①盐酸是强酸、醋酸是弱酸,0.1mol·L-1的盐酸中c(H+)=0.1mol/L,0.1mol·L-1醋酸中c(H+)<0.1mol/L,所以盐酸的pH=1,醋酸的pH>1,根据图知,I是醋酸曲线,Ⅱ是盐酸曲线,故答案为I;
②图I中,V=10时,pH<7,所以c(H+)>c(OH-),根据电荷守恒c(H+)+c(Na+)=c(OH-)+c(CH3COO-),故c(Na+)<c(CH3COO-),故答案为<;
(3)①甲溶液的pH =11,c(H+)=10-11mol/L,c(OH-) =10-3mol/L,故答案为0.001;
②由于氨水是弱碱,c(NH3H2O) >10-3mol/L,c(NaOH) =10-3mol/L,所以25℃时,等体积的甲、乙两溶液与等浓度的盐酸反应,消耗的盐酸体积:甲>乙,故答案为>;
③由于氨水是弱碱,稀释过程中电离程度增大,n(OH-)增大;NaOH是强碱,故甲、乙溶液均加水稀释10倍后,所得溶液的pH:甲>乙,故答案为>;
(4)A.根据表格提供的数据可知HSO3-的酸性介于H2CO3和HCO3-之间,正确的离子方程式为:SO2+2CO32-+H2O=SO32-+2HCO3-,A错误;
B. 根据表格提供的数据可知HClO的酸性介于H2CO3和HCO3-之间,该离子方程式正确,故B正确;
C. HClO能把SO32-氧化成SO42-,C错误;
D.根据表格提供的数据可知醋酸的酸性大于碳酸,该离子方程式正确,D正确;
答案选BD。


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案科目:高中化学 来源: 题型:
【题目】把图二的碎纸片补充到图一中,可得到一个完整的离子方程式。对该离子方程式说法正确的是

A. 配平后的化学计量数依次为3、1、2、6、3
B. 若有1mol的S被氧化,则生成2mol S2-
C. 氧化剂与还原剂的物质的量之比为1:2
D. 2mol的S参加反应有3mol的电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱厂电解饱和氯化钠溶液制取氢氧化钠的工艺流程:
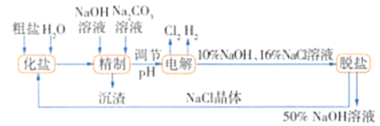
依据图中所给信息,完成下列填空:
(1)电解时发生反应的化学方程式为________________。
(2)粗盐含Ca2+、Mg2+等杂质,加入NaOH溶液、Na2CO3溶液的目的就是除去这些杂质,但如果精制时发现其中SO42-含量也较高,必须添加含钡离子的试剂除去SO42-,该试剂可以是________(填序号)。
a. Ba(OH)2溶液 b.Ba(NO3)2溶液 c.BaCl2溶液
(3)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为________(填序号)。
a.先加NaOH溶液,后加Na2CO3溶液,再加钡试剂
b.先加NaOH溶液,后加钡试剂,再加Na2CO3溶液
c.先加钡试剂,后加NaOH溶液,再加Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列金属的冶炼(“![]() ”前为原料,“
”前为原料,“![]() ”后为所得的金属),①MgCl2→Mg、②MnO2→Mn、③ZnO→Zn、④HgO→Hg、⑤磁铁矿→Fe、⑥NaCl→Na,其中最适宜用热还原法冶炼的是
”后为所得的金属),①MgCl2→Mg、②MnO2→Mn、③ZnO→Zn、④HgO→Hg、⑤磁铁矿→Fe、⑥NaCl→Na,其中最适宜用热还原法冶炼的是
A.①②④⑥B.③④C.②③⑤D.②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中的操作,对应的现象以及结论都正确的是![]()
![]()
选项 | 操作 | 现象 | 结论 |
A | 向 | 产生白色沉淀 |
|
B | 蘸有浓氨水的玻璃捧靠近X | 有白烟产生 | X一定是浓盐酸 |
C | 向澄清石灰水加入某试剂的溶液少许 | 产生白色沉淀 | 该试剂中一定含有 |
D | 炭粉中加入浓硫酸并加热,导出的气体通入 | 有白色沉淀产生 | 有 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用含结晶水的正盐X(四种短周期元素组成的纯净物)进行了如下实验:

实验中观测到:混合气甲呈无色并被蒸馏水全部吸收;固体乙为纯净物;在步骤③中,取1/10溶液丙,恰好中和需消耗0.00200molNaOH;另取一定量的溶液丙,加入少量K2FeO4固体,产生黄绿色气体。
请回答:
(1)X的化学式是__________,步骤①的化学方程式是______________________________。
(2)溶液丙与K2FeO4固体反应的化学方程式是_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)在不同条件下分解产物不同,200℃ 时在Cu表面分解的机理如图1。已知200℃ 时:反应 I: 3N2H4(g)=N2(g)+4NH3(g) △Hl=-32.9 kJ·molˉ1 反应II: N2H4(g)+H2(g)=2NH3(g) △H2=-41.8 kJ·molˉ1,下列说法不正确的是
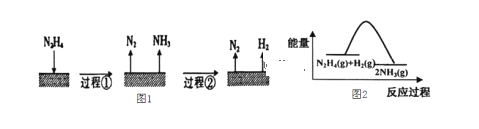
A.图l所示过程①、②都是放热反应
B.反应Ⅱ的能量过程示意图如图2所示
C.断开3 mol N2H4(g)中的化学键吸收的能量小于形成1 mol N2(g)和4 mol NH3(g)中的化学键释放的能量
D.200℃时,肼分解生成氮气和氢气的热化学方程式为N2H4(g)=N2(g)+2H2(g) △H=+50.7 kJ·molˉ1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的离子方程式:
(1) 铜与浓硝酸共热反应_________________________________________________________________
(2) 铝与氢氧化钠溶液反应_______________________________________________________________
(3) 碳与浓硝酸共热反应_________________________________________________________________
(4) 实验室制氯气_______________________________________________________________________
(5) 氧化铝与盐酸反应___________________________________________________________________
(6) 氯化铝与过量氢氧化钠溶液反应_______________________________________________________
(7) 少量二氧化碳通入偏铝酸钠溶液中反应_________________________________________________
(8) 二氧化氮与水反应制硝酸_____________________________________________________________
(9) 锌与稀硝酸反应_____________________________________________________________________
(10) 氯酸钾与浓盐酸常温下反应制氯气____________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验的现象、解释或结论正确的是( )
选项 | 实验 | 解释或结论 |
A | 向某溶液中逐渐通入CO2气体,先出现白色胶状沉淀,继续通入CO2气体,白色胶状沉淀不溶解,证明该溶液中存在AlO2- | Al(OH)3是两性氢氧化物,不溶于碳酸溶液 |
B | 在新制氯水中加入碳酸钙粉末,充分搅拌,氯水的漂白性增强 | 氯水中HClO的物质的量浓度增大 |
C | 用蒸馏法能将溶解在CCl4中的碘分离出来 | 因为碘易升华,先分离出来 |
D | 向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液,则溶液变为黄色 | 氧化性:H2O2 > Fe3+ |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com