
【题目】肼(N2H4)在不同条件下分解产物不同,200℃ 时在Cu表面分解的机理如图1。已知200℃ 时:反应 I: 3N2H4(g)=N2(g)+4NH3(g) △Hl=-32.9 kJ·molˉ1 反应II: N2H4(g)+H2(g)=2NH3(g) △H2=-41.8 kJ·molˉ1,下列说法不正确的是
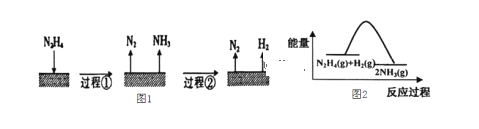
A.图l所示过程①、②都是放热反应
B.反应Ⅱ的能量过程示意图如图2所示
C.断开3 mol N2H4(g)中的化学键吸收的能量小于形成1 mol N2(g)和4 mol NH3(g)中的化学键释放的能量
D.200℃时,肼分解生成氮气和氢气的热化学方程式为N2H4(g)=N2(g)+2H2(g) △H=+50.7 kJ·molˉ1
【答案】A
【解析】
3N2H4(g)=N2(g)+4NH3(g) △Hl=-32.9 kJ·molˉ1 ①
N2H4(g)+H2(g)=2NH3(g) △H2=-41.8 kJ·molˉ1 ②
①-3×②得:2NH3(g)= N2(g)+3H2(g) △Hl=+92.5 kJ·molˉ1
A. 由3N2H4(g)=N2(g)+4NH3(g) △Hl=-32.9 kJ·molˉ1 知,图l所示过程①为放热反应;由上面计算所得的热化学方程式2NH3(g)= N2(g)+3H2(g) △Hl=+92.5 kJ·molˉ1
知,②是吸热反应,A错误;
B. 反应Ⅱ的能量过程示意图如图2所示,与热化学方程式相符,B正确;
C. 由3N2H4(g)=N2(g)+4NH3(g) △Hl=-32.9 kJ·molˉ1知,断开3 mol N2H4(g)中的化学键吸收的能量小于形成1 mol N2(g)和4 mol NH3(g)中的化学键释放的能量,C正确;
D. 200℃时,N2H4(g)+H2(g)=2NH3(g) △H2=-41.8 kJ·molˉ1 ①
2NH3(g)= N2(g)+3H2(g) △Hl=+92.5 kJ·molˉ1 ②
①+②得:N2H4(g)=N2(g)+2H2(g) △H=+50.7 kJ·molˉ1,D正确。
故选A。


科目:高中化学 来源: 题型:
【题目】石油裂化和裂解过程得到的CH2=CH2,在一定条件下可以聚合成高分子化合物。含有 结构的化合物与CH2=CH2一样,可以在一定条件下聚合成高分子化合物。
结构的化合物与CH2=CH2一样,可以在一定条件下聚合成高分子化合物。
(1)广泛用作农用薄膜的聚氯乙烯塑料,是由CH2=CHCl在催化剂、加热的条件下聚合成的,其化学方程式是________________。
(2)电器包装中大量使用的泡沫塑料的主要成分是聚苯乙烯( ),它是由________________(写结构简式)聚合而成的。
),它是由________________(写结构简式)聚合而成的。
(3)CH2=CHCl与聚苯乙烯的单体在一定条件下可发生加聚反应,所得产物的结构简式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中可提取多种化工原料,下图是工业上对海水资源进行综合利用的流程图。试回答下列问题:

(1)若粗盐中含有杂质离子Ca2+、Mg2+、SO42-,精制时所用试剂为A.盐酸、B.BaCl2溶液、C.NaOH溶液、D.Na2CO3溶液。则加入试剂的顺序是________(填序号)。
(2)写出用海滩上的贝壳制Ca(OH)2的化学方程式:________________。
(3)电解熔融MgCl2可制取镁和Cl2,其中Cl2和Ca(OH)2反应可制得漂白粉。制漂白粉的化学方程式为________________。
(4)从经济效益角度考虑,该化工厂厂址应选在________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。下列方法中,可以使醋酸溶液中CH3COOH电离程度增大的是_______。
A. 滴加少量浓盐酸 B. 微热溶液 C. 加水稀释 D. 加入少量醋酸钠晶体
(2)用0.1mol·L-1NaOH溶液分别滴定体积均为 20mL、浓度均为0.1mol·L-1的盐酸和醋酸溶液, 得到滴定过程中溶液 pH 随加入 NaOH 溶液体积而变化的两条滴定曲线。
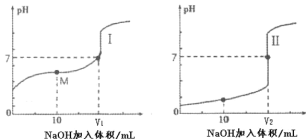
①滴定醋酸的曲线是_______(填“I”或“II”)。
②图I中 V=10 时,溶液中的c(Na+)________c(A-)。(填“>”、“=”或“<”,其中A-代表酸根离子)
(3)下表为某同学所测 25℃时,甲、乙两种溶液的 pH。
甲 | 乙 | |
pH | 11 | 11 |
溶液 | 氨水 | 氢氧化钠溶液 |
①甲溶液中的c(OH-) =_________mol/L。
②25℃时,等体积的甲、乙两溶液与等浓度的盐酸恰好完全反应,消耗的盐酸体积:甲_______乙。(填“>”、“=”或“<”)
③甲、乙溶液均加水稀释 10 倍后,所得溶液的 pH:甲______乙。(填“>”、“=”或“<”)
(4)下表是几种常见弱酸的电离常数
化学式 | CH3COOH | H2SO3 | HClO | H2CO3 |
电离常数 | 1.8×10-5 | K1=1.23×10-2 K2=6.6×10-8 | 3.0×10-8 | K1=4.4×10-7 K2=4.7×10-11 |
以下反应对应的离子方程式正确的是_______。
A.Na2CO3溶液吸收少量SO2:![]() +SO2+H2
+SO2+H2![]() +
+![]()
B.漂白液生效的原理:ClO-+CO2+H2O = HClO+![]()
C.次氯酸钠溶液吸收少量SO2:ClO-+SO2+H2O = HClO+![]()
D.醋酸除水垢中的CaCO3:2CH3COOH+CaCO3= Ca2++2CH3COO-+H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述中,不正确的是( )

A.实验室常用装置①制取NH3
B.装置②中X若为CCl4,可用于吸收NH3,并防止倒吸
C.装置③可用于制备Fe(OH)2并较长时间观察其白色
D.装置④可用于收集NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示。下列说法正确的是( )

A.化合物RX中含共价键
B.化合物X2M是非电解质
C.M的单质在常温常压下为气体
D.Y形成的化合物种类最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一包由Cu、![]() 和CuO组成的混合物均分成两份:一份混合物在加热条件下与
和CuO组成的混合物均分成两份:一份混合物在加热条件下与![]() 充分反应,将固体全部转化成铜粉时固体质量减少了
充分反应,将固体全部转化成铜粉时固体质量减少了![]() ;向另一份混合物中加入
;向另一份混合物中加入![]() 溶液恰好完全反应生成
溶液恰好完全反应生成![]() 和
和![]() 假设不产生其他还原产物
假设不产生其他还原产物![]() ,这些NO和
,这些NO和![]() 标准状况
标准状况![]() 混合并通入足量水中,气体全部被吸收生成
混合并通入足量水中,气体全部被吸收生成![]() 。则该硝酸的物质的量浓度为
。则该硝酸的物质的量浓度为![]()
![]()
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,①和②为两个体积相同的固定容器,图中“![]() ”和“
”和“![]() ”分别表示氢原子和氧原子,则下列说法正确的是( )
”分别表示氢原子和氧原子,则下列说法正确的是( )
①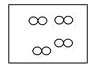 ②
②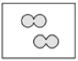
A.若①中的![]() 为4mol,则②中所含原子总数为
为4mol,则②中所含原子总数为![]() 个
个
B.①和②中气体的质量之比为1:8
C.![]() 、
、![]() 均能发生化合反应,但均不能发生置换反应
均能发生化合反应,但均不能发生置换反应
D.两容器的温度和压强均相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丰富多彩的生活材料:
(1)青奥会将于2014年8月在南京举行。青奥会建筑设施使用了大量节能材料,体现了“绿色青奥”的理念。
①用于青奥村工程的隔热保温材料聚氨酯属于___(填字母)。
a.有机高分子材料 b.无机非金属材料 c.金属材料
②青奥中心外墙的复合保温材料采用铝合金锁边。有关铝合金的性质正确的是___(填字母)。
a.强度小 b.耐腐蚀 c.密度大
③青奥会议中心双塔采用了玻璃幕墙设计。制造玻璃的主要原料为纯碱、石灰石和___(填字母)。
a.金刚砂 b.石英 c.水玻璃
(2)生活中处处有化学,化学己渗透到我们的“衣、食、住、行”之中。
①铝合金是生活中常见的材料,具有密度小、强度高的优良性能。其在空气中不易生锈的原因是___。
②玻璃和钢铁是常用的建筑材料。普通玻璃是由Na2SiO3、CaSiO3、___等物质组成的;钢铁制品不仅可发生化学腐蚀,在潮湿的空气中还能发生___腐蚀,生成的铁锈的主要成分是___(填化学式)。
(3)氮化硅是一种新型高温材料,可用于制造汽车发动机。请写出高纯硅和氮气在1300℃反应制备氮化硅的化学方程式:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com