
����Ŀ���ḻ��ʵ�������ϣ�
��1����»Ὣ��2014��8�����Ͼ����С���»Ὠ����ʩʹ���˴������ܲ��ϣ������ˡ���ɫ��¡������
��������´幤�̵ĸ��ȱ��²��Ͼ۰�������___������ĸ����
a���л��߷��Ӳ��� b�����ǽ������� c����������
�����������ǽ�ĸ��ϱ��²��ϲ������Ͻ����ߡ��й����Ͻ��������ȷ����___������ĸ����
a��ǿ��С b����ʴ c���ܶȴ�
����»�������˫�������˲���Ļǽ��ơ����첣������Ҫԭ��Ϊ���ʯ��ʯ��___������ĸ����
a�����ɰ b��ʯӢ c��ˮ����
��2�������д����л�ѧ����ѧ���������ǵġ��¡�ʳ��ס���С�֮�С�
�����Ͻ��������г����IJ��ϣ������ܶ�С��ǿ�ȸߵ��������ܡ����ڿ����в��������ԭ����___��
�ڲ��������dz��õĽ������ϡ���ͨ��������Na2SiO3��CaSiO3��___��������ɵģ�������Ʒ�����ɷ�����ѧ��ʴ���ڳ�ʪ�Ŀ����л��ܷ���___��ʴ�����ɵ��������Ҫ�ɷ���___���ѧʽ����
��3����������һ�������²��ϣ�������������������������д���ߴ���͵�����1300�淴Ӧ�Ʊ�������Ļ�ѧ����ʽ��___��
���𰸡�a b b ��Ϊ���ڳ�����������е�����������ѧ��Ӧ4Al+3O2=2Al2O3��ʹ���ı���������һ�����ܵ���������Ĥ���Ӷ���ֹ���ڲ�������һ�������� SiO2 �绯ѧ���������� Fe2O3xH2O����Fe2O3�� 3Si+2N2![]() Si3N4
Si3N4
��������
��1���پ۰������ڸ߷��Ӻϳɲ��ϣ����л��߷��ӻ����
�ڸ��ݺϽ���ص㣺�۵�ȳɷֽ����ͣ�Ӳ�ȱȳɷֽ��������ܺ�ǿ�ȶ����ڴ��������н��
�����첣������Ҫԭ��Ϊ���ʯ��ʯ��ʯӢ��
��2������Ϊ���ڳ�����������е�����������ѧ��Ӧ��ʹ���ı���������һ�����ܵ���������Ĥ���Ӷ���ֹ���ڲ�������һ����������
����ͨ��������Na2SiO3��CaSiO3��SiO2��������ɵģ�������Ʒ�����ɷ�����ѧ��ʴ���ڳ�ʪ�Ŀ����л��ܷ����绯ѧ��ʴ�������ĸ�ʴ�Ե绯ѧ��ʴ�е�������ʴΪ����
��3����֪�ߴ���͵�����![]() ��Ӧ�Ʊ������裬��ƽ����ʽ���ɡ�
��Ӧ�Ʊ������裬��ƽ����ʽ���ɡ�
��1���پ۰��������л��߷��Ӻϳɲ��ϣ������л��ۺ��
�ʴ�Ϊ��a��
�����Ͻ����ǿ�ȴ���ʴ���ܶ�С�ڳɷֽ������ص㣻
�ʴ�Ϊ��b��
�����첣������Ҫԭ��Ϊ���ʯ��ʯ��ʯӢ��
�ʴ�Ϊ��b��
��2������Ϊ���ڳ�����������е�����������ѧ��Ӧ4Al+3O2=2Al2O3��ʹ���ı���������һ�����ܵ���������Ĥ���Ӷ���ֹ���ڲ�������һ����������
�ʴ�Ϊ����Ϊ���ڳ�����������е�����������ѧ��Ӧ4Al+3O2=2Al2O3��ʹ���ı���������һ�����ܵ���������Ĥ���Ӷ���ֹ���ڲ�������һ����������
����ͨ��������Na2SiO3��CaSiO3��SiO2��������ɵģ�������Ʒ�����ɷ�����ѧ��ʴ���ڳ�ʪ�Ŀ����л��ܷ����绯ѧ��ʴ�������ĸ�ʴ�Ե绯ѧ��ʴ�е�������ʴΪ����������ӦΪFe2e=2Fe2+�������������õ��ӷ�����ԭ��Ӧ���缫��ӦʽΪ2H2O+O2+4e�T4OH-���ܷ�ӦΪ2Fe+O2+2H2O=Fe(OH)2��Fe(OH)2����������ΪFe(OH)3��Fe(OH)3��ˮ�������⣬�������Ҫ�ɷ���Fe2O3xH2O����Fe2O3����
�ʴ�Ϊ��SiO2���绯ѧ������������Fe2O3xH2O����Fe2O3����
��3����֪�ߴ���͵�����![]() ��Ӧ�Ʊ������裬��Ӧ�Ļ�ѧ����ʽ��3Si+2N2
��Ӧ�Ʊ������裬��Ӧ�Ļ�ѧ����ʽ��3Si+2N2![]() Si3N4��
Si3N4��
�ʴ�Ϊ��3Si+2N2![]() Si3N4��
Si3N4��


 �ʰ�Ӣ��ͬ����ϰ��ϵ�д�
�ʰ�Ӣ��ͬ����ϰ��ϵ�д� ѧϰʵ����ϵ�д�
ѧϰʵ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����(N2H4)�ڲ�ͬ�����·ֽ���ﲻͬ��200�� ʱ��Cu����ֽ�Ļ�����ͼ1����֪200�� ʱ����Ӧ I: 3N2H4(g)��N2(g)��4NH3(g) ��Hl��-32.9 kJ��mol��1 ��ӦII: N2H4(g)��H2(g)��2NH3(g) ��H2��-41.8 kJ��mol��1������˵������ȷ����

A.ͼl��ʾ�������������Ƿ��ȷ�Ӧ
B.��Ӧ������������ʾ��ͼ��ͼ2��ʾ
C.�Ͽ�3 mol N2H4(g)�еĻ�ѧ�����յ�����С���γ�1 mol N2(g)��4 mol NH3(g)�еĻ�ѧ���ͷŵ�����
D.200��ʱ���·ֽ����ɵ������������Ȼ�ѧ����ʽΪN2H4(g)��N2(g)��2H2(g) ��H��+50.7 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ܱ������У��ֱ����������ͬ�ļס����������壬�����ǵ��¶Ⱥ��ܶȾ���ͬ���Ը��ݼס��ҵ�Ħ������![]() ��ϵ���ж�����˵����ȷ���ǣ� ��
��ϵ���ж�����˵����ȷ���ǣ� ��
A.��![]() ���������ѹǿ����
���������ѹǿ����![]() ��
��
B.��![]() ���������Ħ���������
���������Ħ���������![]() ��
��
C.��![]() ���������������
���������������![]() ��
��
D.��![]() �������������
�������������![]() ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ��������ͻ������ȷ����( )
ѡ�� | ʵ�� | ���ͻ���� |
A | ��ij��Һ����ͨ��CO2���壬�ȳ��ְ�ɫ��״����������ͨ��CO2���壬��ɫ��״�������ܽ⣬֤������Һ�д���AlO2�� | Al(OH)3�������������������̼����Һ |
B | ��������ˮ�м���̼��Ʒ�ĩ����ֽ��裬��ˮ��Ư������ǿ | ��ˮ��HClO�����ʵ���Ũ������ |
C | �������ܽ��ܽ���CCl4�еĵ������� | ��Ϊ�����������ȷ������ |
D | ��Fe(NO3)2��Һ�е��������ữ��H2O2��Һ������Һ��Ϊ��ɫ | �����ԣ�H2O2 > Fe3+ |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʵ���ҽ��а�����ˮ�ġ���Ȫʵ�顱��װ�ã�������������ȷ����( )
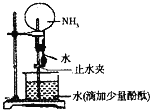
A.��ʵ��˵��������һ�ּ�������ˮ������
B.������ƿ�е�Һ����ɫ����ɫ��Ϊ��ɫ��˵����ˮ�м���
C.��ˮ���ȶ�������ƿ�еĺ�ɫ��Һ���ȣ���ɫ���ᷢ���仯
D.�γɡ���Ȫ������Ҫԭ���ǰ�������ˮ����ƿ�ڵ���ѹС�ڴ���ѹ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����( )
A.ʯ���ѻ�����������͵������͵IJ���������
B.����ʽΪC5H12��ͬ���칹�干��3��
C.��2mL��ˮ�м���1mL�������ã��ɹ۲쵽Һ��ֲ㣬�ϲ���Ϻ�ɫ
D.ú�к��б��ͼױ������ø���ķ��������Ƿ��뿪��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Դ�������ȷ������Ź㷺����;�����������������й㷺��Ӧ�á�
��֪��i����������(Na2FeO4)�����ܽ���ˮ��20���ܽ��Ϊ111�ˣ��������(K2FeO4)Ϊ����ɫ���壬������ˮ��
ii���������(K2FeO4)�����Ի�������Һ���ֽ⣬�ڼ�����Һ���ȶ���
iii�����������ˮ��Һ�д���ƽ�⣺![]()
![]() ��
��
(1)��ҵ�����������ռ���Һ������ȡ�������ƣ���Ӧ�����ӷ���ʽΪ___________��
(2)���������һ�������ˮ���������ȿ��Զ�ˮɱ���������ֿ��Ծ���ˮ����ԭ��Ϊ________��
(3)��ҵ���ж��ַ����Ʊ�������ء�
����1����������������������������ͼ��ʾ��
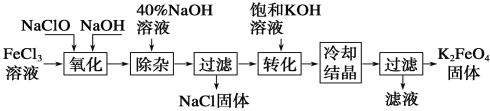
�١������������е�������Ϊ(�ѧʽ)______________��
��д����ת���������еĻ�ѧ����ʽΪ__________________��
���������յõ��ĸ�����س��������ʣ������ؽᾧ���ᴿ�������ǽ��ֲ�Ʒ����ϡKOH��Һ�ܽ⣬Ȼ���ټ��뱥��KOH��Һ����ȴ�ᾧ���ˡ������������ܽ�ֲ�Ʒ��ϡKOH��Һ����������ˮ������ƽ���ƶ�ԭ������__________��
(4)����2����ⷨ
�ҹ���ѧ�������������(Ni)�������缫���ŨNaOH��Һ�Ʊ���������Na2FeO4�ķ�����װ������ͼ��ʾ��
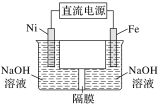
��Ni�缫��________(����������������)����
��Fe�缫�ĵ缫��Ӧʽ��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£���3 mol A��1 mol B�����������ڹ̶��ݻ�Ϊ2 L���ܱ������У�������Ӧ��![]() ��2 minĩ�÷�Ӧ�ﵽƽ�⣬�������0.8 mol D��0.4 mol C�������жϲ���ȷ����
��2 minĩ�÷�Ӧ�ﵽƽ�⣬�������0.8 mol D��0.4 mol C�������жϲ���ȷ����
A.![]() =1
=1
B.2 minʱ��A��Ũ��Ϊ0.9 mol��L-1
C.2 minʱ��A��ƽ����Ӧ����Ϊ0.3 mol��L-1��min-1
D.2 minʱ��B��ƽ����Ӧ����Ϊ0.9 mol��L-1��min-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��W��X��Y��Z��Ϊ������Ԫ�أ�W������������������������֮��Ϊ7��17��X��Wͬ���壻Y��ԭ��������W��X��ԭ������֮�͵�һ�룻��ZԪ�ص�������ɫ��ӦΪ��ɫ�������ж���ȷ���ǣ� ��
A.��̬�⻯����ȶ��ԣ�X��W
B.�����ԣ�Y��Z
C.��ۺ���������ԣ�X��W
D.ԭ�Ӱ뾶��Y��Z��X
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com