
����Ŀ����һ�������£���3 mol A��1 mol B�����������ڹ̶��ݻ�Ϊ2 L���ܱ������У�������Ӧ��![]() ��2 minĩ�÷�Ӧ�ﵽƽ�⣬�������0.8 mol D��0.4 mol C�������жϲ���ȷ����
��2 minĩ�÷�Ӧ�ﵽƽ�⣬�������0.8 mol D��0.4 mol C�������жϲ���ȷ����
A.![]() =1
=1
B.2 minʱ��A��Ũ��Ϊ0.9 mol��L-1
C.2 minʱ��A��ƽ����Ӧ����Ϊ0.3 mol��L-1��min-1
D.2 minʱ��B��ƽ����Ӧ����Ϊ0.9 mol��L-1��min-1

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ���ٺ͢�Ϊ���������ͬ�Ĺ̶�������ͼ����![]() ������
������![]() ���ֱ��ʾ��ԭ�Ӻ���ԭ�ӣ�������˵����ȷ���ǣ� ��
���ֱ��ʾ��ԭ�Ӻ���ԭ�ӣ�������˵����ȷ���ǣ� ��
�� ��
��
A.�����е�![]() Ϊ4mol�����������ԭ������Ϊ
Ϊ4mol�����������ԭ������Ϊ![]() ��
��
B.�ٺ͢������������֮��Ϊ1��8
C.![]() ��
��![]() ���ܷ������Ϸ�Ӧ���������ܷ����û���Ӧ
���ܷ������Ϸ�Ӧ���������ܷ����û���Ӧ
D.���������¶Ⱥ�ѹǿ����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ḻ��ʵ�������ϣ�
��1����»Ὣ��2014��8�����Ͼ����С���»Ὠ����ʩʹ���˴������ܲ��ϣ������ˡ���ɫ��¡������
��������´幤�̵ĸ��ȱ��²��Ͼ۰�������___������ĸ����
a���л��߷��Ӳ��� b�����ǽ������� c����������
�����������ǽ�ĸ��ϱ��²��ϲ������Ͻ����ߡ��й����Ͻ��������ȷ����___������ĸ����
a��ǿ��С b����ʴ c���ܶȴ�
����»�������˫�������˲���Ļǽ��ơ����첣������Ҫԭ��Ϊ���ʯ��ʯ��___������ĸ����
a�����ɰ b��ʯӢ c��ˮ����
��2�������д����л�ѧ����ѧ���������ǵġ��¡�ʳ��ס���С�֮�С�
�����Ͻ��������г����IJ��ϣ������ܶ�С��ǿ�ȸߵ��������ܡ����ڿ����в��������ԭ����___��
�ڲ��������dz��õĽ������ϡ���ͨ��������Na2SiO3��CaSiO3��___��������ɵģ�������Ʒ�����ɷ�����ѧ��ʴ���ڳ�ʪ�Ŀ����л��ܷ���___��ʴ�����ɵ��������Ҫ�ɷ���___���ѧʽ����
��3����������һ�������²��ϣ�������������������������д���ߴ���͵�����1300�淴Ӧ�Ʊ�������Ļ�ѧ����ʽ��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л�����ԭ�ϵĽṹ��ʽ��ͼ��ʾ�����й��ڸ��л����˵����ȷ���ǣ� ��
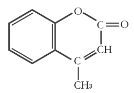
A.1 mol����������ܺ�5mol H2�����ӳɷ�Ӧ
B.��ʹ����KMnO4��Һ��ɫ���ܷ����ӳɷ�Ӧ��ȡ����Ӧ
C.�÷���������ԭ�Ӷ����ܹ�ƽ��
D.�����ʵķ���ʽΪC10H10O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ӵ�����ˮ����ȡ�����������ͼ��ʾ�������й�˵���������(����)
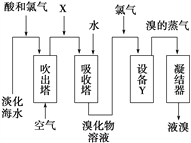
A. XΪSO2���壬Ҳ�ɽ�SO2����Na2SO3
B. �豸YΪ������
C. ����ȡ��Ĺ�����һ����Br��������
D. ��ҵ�ϣ�ÿ���1 mol Br2����Ҫ����Cl2��������Ϊ44.8 L(��״��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���� 100��ʱ���� 0.40 mol NO2 ������� 2 L ���ܱ������У��������·�Ӧ��2NO2(g)![]() N2O4(g) H < 0����ⷴӦ����������ݣ�
N2O4(g) H < 0����ⷴӦ����������ݣ�
ʱ��/s | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
����˵����ȷ����
A.0~20 s �ڣ�v(NO2) = 0.005 mol��L-1.s-1
B.��������Ӧ�� 120��ʱ���У���Ӧ�� 80 s ʱ��n(N2O4) < 0.08 mol
C.��������ʼʱ���� NO2 �������� 0.80 mol����ƽ��ʱ NO2 ת���ʽ�����
D.59 s ʱ��c(NO2)һ������ 0.12 mol��L-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���ȡpH=2�����ֶ�Ԫ��H2A��H2B��1ml���ֱ��ˮϡ�ͣ����pH���ˮϡ�ͱ�������ͼ��ʾ��ϵ���������й���������ȷ����

A. H2B����
B. NaHAˮ��Һ�У�c(Na+)+c(H+)=2c(A2��)+c(OH��)
C. �������ʵ�����NaHA��NaHB�Ļ����Һ�У�c(Na+)=c(A2��)+c(HB��)+c(B2��)+c(H2B)
D. pH=10��NaHB��Һ�У�c(Na+)>c(HB��)>c(B2��)>c(OH��)>c(H2B)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.1000 mol/L��NaOH����Һ�ζ�20.00 mL0.1000 mol/L��HCl��Һ���ζ�������ͼ�������й�˵����ȷ����( )

A.ָʾ����ɫʱ��˵����Ӧ���ᡢ��ǡ�õ����ʵ�����Ӧ
B.���ﵽ�ζ��յ�ʱ�Ŵ���c(Na+)+c(H+)=c(Cl-)+c(OH-)
C.�ﵽ�ζ��յ�ʱ���ü�����ָʾ������NaOH��Һ������÷�̪��
D.��֪H+(aq)+OH-(aq)=H2O(l)��H=-57.3 kJ/mol�������ζ�ǡ���к�ʱ���ų�114.6J������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��K3[Fe(C2O4)3]��3H2O�����������(��)��ؾ��塳���Ʊ������ͻ�������������Ҫԭ�ϣ�Ҳ��һЩ�л���Ӧ�ܺõĴ�������ͼ����ʵ�����Ʊ�K3[Fe(C2O4)3]��3H2O�����̣�
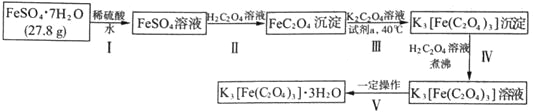
�ش��������⣺
��1������I�м���ϡ�����Ŀ����_______________��
����II�з�������Ҫ��ѧ��ӦΪһ������̣������ӷ���ʽΪ_______________��
�����£��÷�Ӧ��ƽ�ⳣ��K=_______________[��֪�����£�Ka1(H2C2O4)=5.6��10-2��Ka2(H2C2O4)=5.4��10-5��Ksp(FeC2O4)=2.1��10-7]
��2�������Լ����ɽ�FeC2O4����ΪK3[Fe(C2O4)3]����������Ϊ���Լ�a������_______________(�����)
a����ˮb������KMnO4��Һc��H2O2��Һd��ϡ����
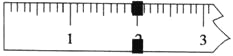
��3��ʹ��������ƽ�����Ƶõ�K3[Fe(C2O4)3]��3H2O����������ƽƽ��ʱ�������������������Ϊ20 g������ʾ����ͼ��ʾ�����Ƶþ��������Ϊ___________g����ʵ����K3[Fe(C2O4)3]��3H2O�IJ���Ϊ_______________��(��֪�� K3[Fe(C2O4)3]��3H2O����Է�������Ϊ491��FeSO4��7H2O����Է�������Ϊ278)
��4��ij�о�С�齫K3[Fe(C2O4)3����һ�������¼��ȷֽ��������ͼ��ʾװ��(���ظ�ʹ��)ȷ�����ú�̼Ԫ�ص��������ΪCO��CO2��
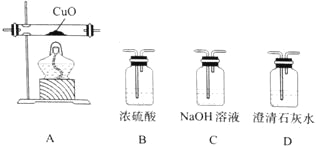
�����������ҵķ���װ�õ�����˳��Ϊ_______________(��װ�����) ��ȷ����������к�CO������Ϊ_______________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com