
【题目】常温下,用0.1000 mol/L的NaOH标准溶液滴定20.00 mL0.1000 mol/L的HCl溶液,滴定曲线如图,下列有关说法正确的是( )

A.指示剂变色时,说明反应的酸、碱恰好等物质的量反应
B.当达到滴定终点时才存在c(Na+)+c(H+)=c(Cl-)+c(OH-)
C.达到滴定终点时,用甲基橙作指示剂消耗NaOH溶液体积比用酚酞多
D.已知H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ/mol,上述滴定恰好中和时,放出114.6J的热量
【答案】D
【解析】
A.指示剂为酚酞,变色范围为8.1~10.0,滴定终点呈碱性,指示剂变色时,氢氧化钠稍过量,A错误;
B.滴定反应是NaOH溶液滴定盐酸溶液,根据电荷守恒,整个滴定过程都存在c(Na+)+c(H+)=c(Cl-)+c(OH-),不仅仅是达到滴定终点才会存在,B错误;
C.甲基橙做指示剂,甲基橙变色范围3.1~4.4,变色范围在酸性时,酚酞变色范围是8.1~10,变色范围在碱性时,显然用甲基橙作指示剂消耗NaOH溶液体积比用酚酞少,C错误;
D.H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ/mol,滴定所用的酸和碱为0.1000 mol/L的NaOH标准溶液滴定20.00 mL0.1000 mol/L的HCl溶液,则反应的物质的量为n=0.1000×20.00×10-3 mol=0.002 mol,则滴定恰好中和时,放出热量Q=57.3×0.002 kJ=114.6 J,D正确;
故合理选项是D。


科目:高中化学 来源: 题型:
【题目】下列实验的现象、解释或结论正确的是( )
选项 | 实验 | 解释或结论 |
A | 向某溶液中逐渐通入CO2气体,先出现白色胶状沉淀,继续通入CO2气体,白色胶状沉淀不溶解,证明该溶液中存在AlO2- | Al(OH)3是两性氢氧化物,不溶于碳酸溶液 |
B | 在新制氯水中加入碳酸钙粉末,充分搅拌,氯水的漂白性增强 | 氯水中HClO的物质的量浓度增大 |
C | 用蒸馏法能将溶解在CCl4中的碘分离出来 | 因为碘易升华,先分离出来 |
D | 向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液,则溶液变为黄色 | 氧化性:H2O2 > Fe3+ |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生反应:![]() 。2 min末该反应达到平衡,测得生成0.8 mol D、0.4 mol C。下列判断不正确的是
。2 min末该反应达到平衡,测得生成0.8 mol D、0.4 mol C。下列判断不正确的是
A.![]() =1
=1
B.2 min时,A的浓度为0.9 mol·L-1
C.2 min时,A的平均反应速率为0.3 mol·L-1·min-1
D.2 min时,B的平均反应速率为0.9 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得推论正确的是
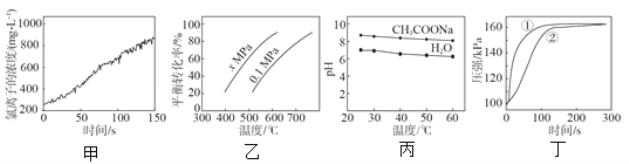
A.甲是新制氯水光照过程中氯离子浓度的变化曲线,推断次氯酸分解生成了 HCl 和 O2
B.乙是 C4H10(g)![]() C4H8(g) + H2(g)的平衡转化率与温度和压强的关系曲线,推断该反应的H>0、x>0.1
C4H8(g) + H2(g)的平衡转化率与温度和压强的关系曲线,推断该反应的H>0、x>0.1
C.丁是 0.03g 镁条分别与 2 mL 2 mol/L 盐酸和醋酸反应过程中密闭容器内气体压强随时间的变化曲线,推断①代表盐酸与镁条的反应
D.丙是 0.5 mol/L CH3COONa 溶液及水的 pH 随温度的变化曲线,说明随温度升高,CH3COONa 溶液中 c(OH-)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于实验的描述不正确的是( )
A.使用容量瓶配制溶液时,俯视液面定容后所得溶液的浓度偏低
B.过滤时,玻璃棒靠在三层滤纸边沿稍下方
C.在镀件上电镀铜时,可用金属铜作阳极
D.在用Fe(OH)3胶体溶液做电泳实验时,阴极区红色加深,可知Fe(OH)3胶体粒子带正电荷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸滴定碱时,滴定前读酸式滴定管读数时视线低于水平线,滴定结束时读数正确,这样会使测得的碱溶液的浓度
A.偏高B.偏低C.不受影响D.不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z均为短周期元素,W的最外层电子数与核外电子总数之比为7:17;X与W同主族;Y的原子序数是W和X的原子序数之和的一半;含Z元素的物质焰色反应为黄色。下列判断正确的是( )
A.气态氢化物的稳定性:X﹥W
B.金属性:Y﹥Z
C.最高价含氧酸的酸性:X﹥W
D.原子半径:Y﹥Z﹥X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)海水资源的利用具有广阔前景。海水中主要离子的含量如下:
成分 | 含量/(mg/L) | 成分 | 含量/(mg/L) |
Cl- | 18980 | Ca2+ | 400 |
Na+ | 10560 |
| 142 |
| 2560 | Br- | 64 |
Mg2+ | 1272 |
电渗析法淡化海水示意图如图所示,其中阴(阳) 离子交换膜仅允许阴(阳)离子通过。
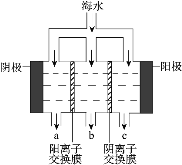
①电解氯化钠溶液的离子方程式_____。
②电解过程中阴极区碱性明显增强,用平衡移动原理 解释原因_____。 在阴极附近产生少量白色沉淀,其成分有_________和CaCO3。
③淡水的出口为_________(填“a”、“b”或“c”);a 出口物质为_____(填化学式)。
④若用下面燃料电池为电源电解 100mL1molL-1 氯化钠溶液,当电池消耗0.00025 molO2 时,常温下,所得溶液的 pH 为__________(忽略反应前后溶液体积变化)
(2)如图Ⅰ是氢氧燃料电池(电解质为 KOH 溶液)的结构示意图,
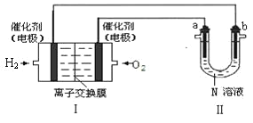
①Ⅰ中通入O2的一端为电池的_____极。 通入H2的一端的电极反应式_________
②若在Ⅱ中实现锌片上镀铜,则 b 的电极材料是_____,N 溶液为_____溶液。
③若在Ⅱ中实现 Cu+H2SO4= CuSO4+H2↑,则a 极的反应式是_____,N 溶液为 _____溶液。
(3)工业上用 Na2SO3 溶液吸收 SO2,过程中往往得到 Na2SO3 和 NaHSO3的混合溶液,溶液 pH 随 n(![]() ):n(
):n(![]() ) 变化关系如下表:
) 变化关系如下表:
n( | 91:9 | 1:1 | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
当吸收液的 pH 降至约为 6 时,送至电解槽再生。再生示意图如下,结合图示回答:

①![]() 在阳极放电的电极反应式是_____。
在阳极放电的电极反应式是_____。
②当阴极室中溶液 pH升至 8 以上时,吸收液再生并循环利用。简述再生原理:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)CH3OH(g) △H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是( )
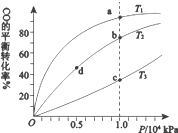
A.温度:T1>T2>T3
B.正反应速率:v(b)>v(d) v(a)>v(c)
C.平衡常数:K(a)>K(c) K(b)=K(d)
D.平均摩尔质量:M(b)>M(d) M(a)<M(c)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com