
【题目】下列金属的冶炼(“![]() ”前为原料,“
”前为原料,“![]() ”后为所得的金属),①MgCl2→Mg、②MnO2→Mn、③ZnO→Zn、④HgO→Hg、⑤磁铁矿→Fe、⑥NaCl→Na,其中最适宜用热还原法冶炼的是
”后为所得的金属),①MgCl2→Mg、②MnO2→Mn、③ZnO→Zn、④HgO→Hg、⑤磁铁矿→Fe、⑥NaCl→Na,其中最适宜用热还原法冶炼的是
A.①②④⑥B.③④C.②③⑤D.②③④⑤
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
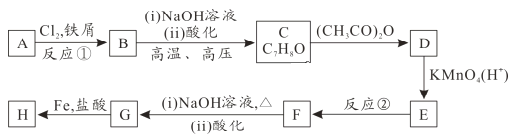
【题目】有机化合物H的结构简式为![]() ,其合成路线如下(部分反应略去试剂和条件):
,其合成路线如下(部分反应略去试剂和条件):
已知:①![]()
②![]() (苯胺易被氧化)
(苯胺易被氧化)
请回答下列问题:
(1)烃A的名称为_______,B中官能团为_______,H的分子式为_______,反应②的反应类型是_______。
(2)上述流程中设计C→D的目的是_______。
(3)写出D与足量NaOH溶液反应的化学方程式为_______。
(4)符合下列条件的D的同分异构体共有_______种。
A.属于芳香族化合物 B.既能发生银镜反应又能发生水解反应
写出其中核磁共振氢谱图中峰面积之比为6∶2∶1∶1的同分异构体的结构简式:______。(任写一种)
(5)已知:苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位,据此按先后顺序写出以烃A为原料合成邻氨基苯甲酸(![]() )合成路线(无机试剂任选)。_______
)合成路线(无机试剂任选)。_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由 N2O 和 NO 反应生成 N2 和 NO2 的能量变化如图所示。下列说法不正确的是
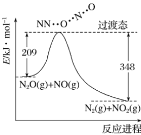
A.反应生成 1 mol N2 时转移 2 mol e-
B.反应物能量之和大于生成物能量之和
C.N2O(g)+NO(g)=N2(g)+NO2(g) ΔH=-139 kJ·mol-1
D.断键吸收能量之和大于成键释放能量之和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图, 水槽中试管内有一枚铁钉,放置数天观察:
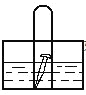
(1)若液面上升,则溶液呈______性,发生______腐蚀,电极反应式为:负极:______________,正极:___________________。
(2)若液面下降,则溶液呈________性,发生_________腐蚀,电极反应式为:负极:______________;正极:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中可提取多种化工原料,下图是工业上对海水资源进行综合利用的流程图。试回答下列问题:

(1)若粗盐中含有杂质离子Ca2+、Mg2+、SO42-,精制时所用试剂为A.盐酸、B.BaCl2溶液、C.NaOH溶液、D.Na2CO3溶液。则加入试剂的顺序是________(填序号)。
(2)写出用海滩上的贝壳制Ca(OH)2的化学方程式:________________。
(3)电解熔融MgCl2可制取镁和Cl2,其中Cl2和Ca(OH)2反应可制得漂白粉。制漂白粉的化学方程式为________________。
(4)从经济效益角度考虑,该化工厂厂址应选在________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)![]() N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是()
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是()
A | B | C | D |
|
|
|
|
升高温度,正反应方向平衡常数减小 | 0~3s内,反应速率为:v(NO2)=0.2 mol·L-1·s-1 | t1时仅加入催化剂,平衡正向移动 | 达平衡时,仅改变x,则x为c(O2) |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。下列方法中,可以使醋酸溶液中CH3COOH电离程度增大的是_______。
A. 滴加少量浓盐酸 B. 微热溶液 C. 加水稀释 D. 加入少量醋酸钠晶体
(2)用0.1mol·L-1NaOH溶液分别滴定体积均为 20mL、浓度均为0.1mol·L-1的盐酸和醋酸溶液, 得到滴定过程中溶液 pH 随加入 NaOH 溶液体积而变化的两条滴定曲线。
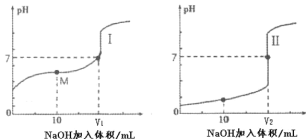
①滴定醋酸的曲线是_______(填“I”或“II”)。
②图I中 V=10 时,溶液中的c(Na+)________c(A-)。(填“>”、“=”或“<”,其中A-代表酸根离子)
(3)下表为某同学所测 25℃时,甲、乙两种溶液的 pH。
甲 | 乙 | |
pH | 11 | 11 |
溶液 | 氨水 | 氢氧化钠溶液 |
①甲溶液中的c(OH-) =_________mol/L。
②25℃时,等体积的甲、乙两溶液与等浓度的盐酸恰好完全反应,消耗的盐酸体积:甲_______乙。(填“>”、“=”或“<”)
③甲、乙溶液均加水稀释 10 倍后,所得溶液的 pH:甲______乙。(填“>”、“=”或“<”)
(4)下表是几种常见弱酸的电离常数
化学式 | CH3COOH | H2SO3 | HClO | H2CO3 |
电离常数 | 1.8×10-5 | K1=1.23×10-2 K2=6.6×10-8 | 3.0×10-8 | K1=4.4×10-7 K2=4.7×10-11 |
以下反应对应的离子方程式正确的是_______。
A.Na2CO3溶液吸收少量SO2:![]() +SO2+H2
+SO2+H2![]() +
+![]()
B.漂白液生效的原理:ClO-+CO2+H2O = HClO+![]()
C.次氯酸钠溶液吸收少量SO2:ClO-+SO2+H2O = HClO+![]()
D.醋酸除水垢中的CaCO3:2CH3COOH+CaCO3= Ca2++2CH3COO-+H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示。下列说法正确的是( )

A.化合物RX中含共价键
B.化合物X2M是非电解质
C.M的单质在常温常压下为气体
D.Y形成的化合物种类最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分中学化学常见元素原子结构及性质如下表所示
元素 | 结构及性质 |
A | 元素A在第三周期中简单离子半径最小 |
B | B原子最外层电子数是内层电子数的0.6 |
C | 使用最广泛的金属元素C能形成两种氯化物,其相对分子质量之差为35.5 |
D | 元素D与B同主族,且大多数情况下D不显正化合价 |
E | 元素E在周期表中位于ⅠA族,有人认为将其排在ⅦA族也有一定道理 |
F | 元素F与B同周期,其最高价氧化物的水化物与A或B的最高价氧化物的水化物均能反应 |
(1)元素C在周期表中的位置是____元素;元素E形成的一种简单离子能支持“将元素E排在ⅦA族”这一观点,该离子的结构示意图为___。
(2)元素E与D可以按原子个数比2∶1、1∶1形成两种化合物X、Y,区别X、Y这两种物质的实验方法为 __。E与B形成的一种化合物Z与X、Y中的一种电子总数相同且能发生化学反应,写出该反应的化学方程式:___(用相应化学式表示)。
(3)请画出化合物F2B2的电子式:_____,该化合物中含有的化学键类型是___。
(4)元素A与元素F相比,金属性较强的是_________ (用元素符号表示),下列表述正确且能证明这一事实的是___(填字母代号)。
a.对应单质与酸反应时,每个A原子比每个F原子失电子多
b.对应单质与同浓度盐酸反应时,F比A剧烈得多
c.A的氧化物熔点比F的氧化物熔点高
d.F可将A从其盐溶液中置换出来
e.最高价氧化物对应的水化物的碱性F比A的强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com