
【题目】部分中学化学常见元素原子结构及性质如下表所示
元素 | 结构及性质 |
A | 元素A在第三周期中简单离子半径最小 |
B | B原子最外层电子数是内层电子数的0.6 |
C | 使用最广泛的金属元素C能形成两种氯化物,其相对分子质量之差为35.5 |
D | 元素D与B同主族,且大多数情况下D不显正化合价 |
E | 元素E在周期表中位于ⅠA族,有人认为将其排在ⅦA族也有一定道理 |
F | 元素F与B同周期,其最高价氧化物的水化物与A或B的最高价氧化物的水化物均能反应 |
(1)元素C在周期表中的位置是____元素;元素E形成的一种简单离子能支持“将元素E排在ⅦA族”这一观点,该离子的结构示意图为___。
(2)元素E与D可以按原子个数比2∶1、1∶1形成两种化合物X、Y,区别X、Y这两种物质的实验方法为 __。E与B形成的一种化合物Z与X、Y中的一种电子总数相同且能发生化学反应,写出该反应的化学方程式:___(用相应化学式表示)。
(3)请画出化合物F2B2的电子式:_____,该化合物中含有的化学键类型是___。
(4)元素A与元素F相比,金属性较强的是_________ (用元素符号表示),下列表述正确且能证明这一事实的是___(填字母代号)。
a.对应单质与酸反应时,每个A原子比每个F原子失电子多
b.对应单质与同浓度盐酸反应时,F比A剧烈得多
c.A的氧化物熔点比F的氧化物熔点高
d.F可将A从其盐溶液中置换出来
e.最高价氧化物对应的水化物的碱性F比A的强
【答案】第四周期第Ⅷ族 ![]() 分别取两种液体少量于试管中,加入少量二氧化锰,有大量气泡冒出的是H2O2 H2O2+H2S===S↓+2H2O
分别取两种液体少量于试管中,加入少量二氧化锰,有大量气泡冒出的是H2O2 H2O2+H2S===S↓+2H2O ![]() 离子键、非极性共价键 Na be
离子键、非极性共价键 Na be
【解析】
元素A在第三周期中简单离子半径最小,则A为Al;B原子最外层电子数是内层电子数的0.6,则内层电子为10,外层为6,B为S;使用最广泛的金属元素C能形成两种氯化物,其相对分子质量之差为35.5,则C为Fe;元素D与S同主族,且大多数情况下D不显正化合价,则D为O;元素E在周期表中位于ⅠA族,有人认为将其排在ⅦA族也有一定道理,其可显示-1价,E为H;元素F与B同周期,其最高价氧化物的水化物与A或B的最高价氧化物的水化物均能反应,F的氢氧化物显两性,则F为Na。
(1)元素C为Fe,在周期表中的位置为第四周期Ⅷ族;元素E为H,将元素E排在ⅦA族”这一观点时,其显-1价,H-离子的结构示意图为![]() ;
;
(2)元素E与D分别为H、O,按原子个数比2∶1、1∶1形成两种化合物X、Y分别为H2O、H2O2,过氧化氢在二氧化锰作催化剂的条件下生成氧气,而水无此性质,实验为分别取两种液体少量于试管中,加入少量二氧化锰,有大量气泡冒出的是H2O2;E与B分别为H、S,形成的一种化合物Z为H2S,与H2O2的电子数相等,发生反应时生成S和水,方程式为H2O2+H2S===S↓+2H2O;
(3) F、B分别为Na、S,形成的化合物F2B2为Na2S2,其电子式为![]() ;该化合物为离子化合物,含有离子键、非极性共价键;
;该化合物为离子化合物,含有离子键、非极性共价键;
(4) 元素A与元素F分别为Al、Na,金属性较强的为Na;
a.Al、Na与酸反应时,金属性的强弱与失电子个数的多少无关,a错误;
b.对应单质与同浓度盐酸反应时,金属性越强,则金属反应的越剧烈,Na比Al剧烈得多,则Na的金属性比Al强,b正确;
c.金属的氧化物熔点与金属的金属性无关,则熔点的高低不能确定金属性的强弱,c错误;
d.Na不能将Al从其盐溶液中置换出来,d错误;
e.金属的金属性越强,则其最高价氧化物对应的水化物的碱性越强,Na比Al的强,则Na的金属性比Al强,e正确;
答案为be。


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
【题目】下列金属的冶炼(“![]() ”前为原料,“
”前为原料,“![]() ”后为所得的金属),①MgCl2→Mg、②MnO2→Mn、③ZnO→Zn、④HgO→Hg、⑤磁铁矿→Fe、⑥NaCl→Na,其中最适宜用热还原法冶炼的是
”后为所得的金属),①MgCl2→Mg、②MnO2→Mn、③ZnO→Zn、④HgO→Hg、⑤磁铁矿→Fe、⑥NaCl→Na,其中最适宜用热还原法冶炼的是
A.①②④⑥B.③④C.②③⑤D.②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的离子方程式:
(1) 铜与浓硝酸共热反应_________________________________________________________________
(2) 铝与氢氧化钠溶液反应_______________________________________________________________
(3) 碳与浓硝酸共热反应_________________________________________________________________
(4) 实验室制氯气_______________________________________________________________________
(5) 氧化铝与盐酸反应___________________________________________________________________
(6) 氯化铝与过量氢氧化钠溶液反应_______________________________________________________
(7) 少量二氧化碳通入偏铝酸钠溶液中反应_________________________________________________
(8) 二氧化氮与水反应制硝酸_____________________________________________________________
(9) 锌与稀硝酸反应_____________________________________________________________________
(10) 氯酸钾与浓盐酸常温下反应制氯气____________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,等质量的O2和CO2相比较,下列叙述正确的是
A.体积比为8:11B.分子个数之比为11:12
C.物质的密度之比为11:8D.原子个数之比为11:12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若它们的温度和密度均相同,试根据甲、乙的摩尔质量![]() 关系,判断下列说法正确的是( )
关系,判断下列说法正确的是( )
A.若![]() ,则气体的压强:甲
,则气体的压强:甲![]() 乙
乙
B.若![]() ,则气体的摩尔体积:甲
,则气体的摩尔体积:甲![]() 乙
乙
C.若![]() ,则气体体积:甲
,则气体体积:甲![]() 乙
乙
D.若![]() ,则分子数:甲
,则分子数:甲![]() 乙
乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,在A处通入氯气,关闭B阀时,C处的红布条看不到明显现象;当打开B阀后,C处的红布条逐渐褪色.有以下几种溶液,则D瓶中盛放的溶液可能是
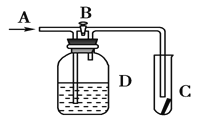
①浓硫酸 ②NaOH溶液 ③H2O ④饱和氯化钠溶液
A.①③B.①②C.②③D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验的现象、解释或结论正确的是( )
选项 | 实验 | 解释或结论 |
A | 向某溶液中逐渐通入CO2气体,先出现白色胶状沉淀,继续通入CO2气体,白色胶状沉淀不溶解,证明该溶液中存在AlO2- | Al(OH)3是两性氢氧化物,不溶于碳酸溶液 |
B | 在新制氯水中加入碳酸钙粉末,充分搅拌,氯水的漂白性增强 | 氯水中HClO的物质的量浓度增大 |
C | 用蒸馏法能将溶解在CCl4中的碘分离出来 | 因为碘易升华,先分离出来 |
D | 向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液,则溶液变为黄色 | 氧化性:H2O2 > Fe3+ |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.石油裂化可以提高汽油等轻质油的产量和质量
B.分子式为C5H12的同分异构体共有3种
C.向2mL碘水中加入1mL苯,振荡后静置,可观察到液体分层,上层呈紫红色
D.煤中含有苯和甲苯,可用干馏的方法将它们分离开来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得推论正确的是
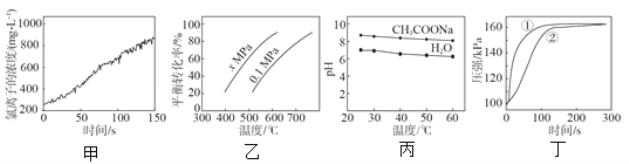
A.甲是新制氯水光照过程中氯离子浓度的变化曲线,推断次氯酸分解生成了 HCl 和 O2
B.乙是 C4H10(g)![]() C4H8(g) + H2(g)的平衡转化率与温度和压强的关系曲线,推断该反应的H>0、x>0.1
C4H8(g) + H2(g)的平衡转化率与温度和压强的关系曲线,推断该反应的H>0、x>0.1
C.丁是 0.03g 镁条分别与 2 mL 2 mol/L 盐酸和醋酸反应过程中密闭容器内气体压强随时间的变化曲线,推断①代表盐酸与镁条的反应
D.丙是 0.5 mol/L CH3COONa 溶液及水的 pH 随温度的变化曲线,说明随温度升高,CH3COONa 溶液中 c(OH-)减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com