
【题目】写出下列反应的离子方程式:
(1) 铜与浓硝酸共热反应_________________________________________________________________
(2) 铝与氢氧化钠溶液反应_______________________________________________________________
(3) 碳与浓硝酸共热反应_________________________________________________________________
(4) 实验室制氯气_______________________________________________________________________
(5) 氧化铝与盐酸反应___________________________________________________________________
(6) 氯化铝与过量氢氧化钠溶液反应_______________________________________________________
(7) 少量二氧化碳通入偏铝酸钠溶液中反应_________________________________________________
(8) 二氧化氮与水反应制硝酸_____________________________________________________________
(9) 锌与稀硝酸反应_____________________________________________________________________
(10) 氯酸钾与浓盐酸常温下反应制氯气____________________________________________________
【答案】Cu+4H++2NO3-==Cu2++2NO2↑+2H2O 2Al+2OH-+2H2O=2AlO2-+3H2↑ C+4H++4NO3-![]() CO2↑+4NO2↑+2H2O MnO2+4H++2Cl-
CO2↑+4NO2↑+2H2O MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O Al2O3+6H+=2Al3++3H2O Al3++4OH-=AlO2-+2H2O CO2+3H2O+2AlO2-=2Al(OH)3 ↓+CO32ˉ 3NO2+H2O=2H++2NO3-+NO 3Zn+8H++2NO3-=3Zn2++2NO↑+4H2O ClO3-+6H++5Cl-=3Cl2↑+3H2O
Mn2++Cl2↑+2H2O Al2O3+6H+=2Al3++3H2O Al3++4OH-=AlO2-+2H2O CO2+3H2O+2AlO2-=2Al(OH)3 ↓+CO32ˉ 3NO2+H2O=2H++2NO3-+NO 3Zn+8H++2NO3-=3Zn2++2NO↑+4H2O ClO3-+6H++5Cl-=3Cl2↑+3H2O
【解析】
(1) 铜与浓硝酸共热,发生氧化还原反应,铜被氧化最终生成硝酸铜,硝酸被还原为二氧化氮;
(2) 铝与氢氧化钠溶液反应,铝作还原剂,最终转化为偏铝酸钠,水作氧化剂,被还原为氢气;
(3) 碳与浓硝酸共热反应,碳作还原剂,被氧化为二氧化碳,浓硝酸被还原为二氧化氮;
(4) 实验室制氯气,使用二氧化锰与浓盐酸共热,二氧化锰作氧化剂,被还原为Mn2+,Cl-被氧化为氯气;
(5) 氧化铝与盐酸反应,发生复分解反应,生成氯化铝和水;
(6) 氯化铝与过量氢氧化钠溶液反应,铝最终转化为偏铝酸钠;
(7) 少量二氧化碳通入偏铝酸钠溶液中反应,生成氢氧化铝沉淀和碳酸钠;
(8) 二氧化氮与水反应,在生成硝酸的同时,还有一氧化氮生成;
(9) 锌与稀硝酸反应,生成硝酸锌、一氧化氮气体和水;
(10) 氯酸钾与浓盐酸常温下反应制氯气,在此反应中盐酸中的HCl一部分表现出酸性,生成氯化钾,一部分表现出还原性,与氯酸钾中的氯共同生成氯气。
(1) 铜与浓硝酸共热,发生氧化还原反应,铜被氧化最终生成硝酸铜,硝酸被还原为二氧化氮,离子方程式为Cu+4H++2NO3-==Cu2++2NO2↑+2H2O;答案为Cu+4H++2NO3-==Cu2++2NO2↑+2H2O;
(2) 铝与氢氧化钠溶液反应,铝作还原剂,最终转化为偏铝酸钠,水作氧化剂,被还原为氢气,离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;答案为2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3) 碳与浓硝酸共热反应,碳作还原剂,被氧化为二氧化碳,浓硝酸被还原为二氧化氮,离子方程式为C+4H++4NO3-![]() CO2↑+4NO2↑+2H2O;答案为C+4H++4NO3-
CO2↑+4NO2↑+2H2O;答案为C+4H++4NO3-![]() CO2↑+4NO2↑+2H2O;
CO2↑+4NO2↑+2H2O;
(4) 实验室制氯气,使用二氧化锰与浓盐酸共热,二氧化锰作氧化剂,被还原为Mn2+,Cl-被氧化为氯气,离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;答案为MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;答案为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(5) 氧化铝与盐酸反应,发生复分解反应,生成氯化铝和水,离子方程式为Al2O3+6H+=2Al3++3H2O;答案为Al2O3+6H+=2Al3++3H2O
(6) 氯化铝与过量氢氧化钠溶液反应,铝最终转化为偏铝酸钠,离子方程式为Al3++4OH-=AlO2-+2H2O;答案为Al3++4OH-=AlO2-+2H2O;
(7) 少量二氧化碳通入偏铝酸钠溶液中反应,生成氢氧化铝沉淀和碳酸钠,离子方程式为CO2+3H2O+2AlO2-=2Al(OH)3 ↓+CO32ˉ;答案为CO2+3H2O+2AlO2-=2Al(OH)3 ↓+CO32ˉ;
(8) 二氧化氮与水反应,在生成硝酸的同时,还有一氧化氮生成,离子方程式为3NO2+H2O=2H++2NO3-+NO;答案为3NO2+H2O=2H++2NO3-+NO;
(9) 锌与稀硝酸反应,生成硝酸锌、一氧化氮气体和水,离子方程式为3Zn+8H++2NO3-=3Zn2++2NO↑+4H2O;答案为3Zn+8H++2NO3-=3Zn2++2NO↑+4H2O;
(10) 氯酸钾与浓盐酸常温下反应制氯气,在此反应中盐酸中的HCl一部分表现出酸性,生成氯化钾,一部分表现出还原性,与氯酸钾中的氯共同生成氯气,离子方程式为ClO3-+6H++5Cl-=3Cl2↑+3H2O;答案为ClO3-+6H++5Cl-=3Cl2↑+3H2O。


科目:高中化学 来源: 题型:
【题目】由 N2O 和 NO 反应生成 N2 和 NO2 的能量变化如图所示。下列说法不正确的是
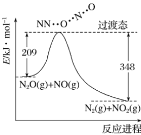
A.反应生成 1 mol N2 时转移 2 mol e-
B.反应物能量之和大于生成物能量之和
C.N2O(g)+NO(g)=N2(g)+NO2(g) ΔH=-139 kJ·mol-1
D.断键吸收能量之和大于成键释放能量之和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。下列方法中,可以使醋酸溶液中CH3COOH电离程度增大的是_______。
A. 滴加少量浓盐酸 B. 微热溶液 C. 加水稀释 D. 加入少量醋酸钠晶体
(2)用0.1mol·L-1NaOH溶液分别滴定体积均为 20mL、浓度均为0.1mol·L-1的盐酸和醋酸溶液, 得到滴定过程中溶液 pH 随加入 NaOH 溶液体积而变化的两条滴定曲线。
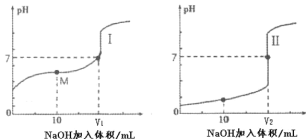
①滴定醋酸的曲线是_______(填“I”或“II”)。
②图I中 V=10 时,溶液中的c(Na+)________c(A-)。(填“>”、“=”或“<”,其中A-代表酸根离子)
(3)下表为某同学所测 25℃时,甲、乙两种溶液的 pH。
甲 | 乙 | |
pH | 11 | 11 |
溶液 | 氨水 | 氢氧化钠溶液 |
①甲溶液中的c(OH-) =_________mol/L。
②25℃时,等体积的甲、乙两溶液与等浓度的盐酸恰好完全反应,消耗的盐酸体积:甲_______乙。(填“>”、“=”或“<”)
③甲、乙溶液均加水稀释 10 倍后,所得溶液的 pH:甲______乙。(填“>”、“=”或“<”)
(4)下表是几种常见弱酸的电离常数
化学式 | CH3COOH | H2SO3 | HClO | H2CO3 |
电离常数 | 1.8×10-5 | K1=1.23×10-2 K2=6.6×10-8 | 3.0×10-8 | K1=4.4×10-7 K2=4.7×10-11 |
以下反应对应的离子方程式正确的是_______。
A.Na2CO3溶液吸收少量SO2:![]() +SO2+H2
+SO2+H2![]() +
+![]()
B.漂白液生效的原理:ClO-+CO2+H2O = HClO+![]()
C.次氯酸钠溶液吸收少量SO2:ClO-+SO2+H2O = HClO+![]()
D.醋酸除水垢中的CaCO3:2CH3COOH+CaCO3= Ca2++2CH3COO-+H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示。下列说法正确的是( )

A.化合物RX中含共价键
B.化合物X2M是非电解质
C.M的单质在常温常压下为气体
D.Y形成的化合物种类最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一包由Cu、![]() 和CuO组成的混合物均分成两份:一份混合物在加热条件下与
和CuO组成的混合物均分成两份:一份混合物在加热条件下与![]() 充分反应,将固体全部转化成铜粉时固体质量减少了
充分反应,将固体全部转化成铜粉时固体质量减少了![]() ;向另一份混合物中加入
;向另一份混合物中加入![]() 溶液恰好完全反应生成
溶液恰好完全反应生成![]() 和
和![]() 假设不产生其他还原产物
假设不产生其他还原产物![]() ,这些NO和
,这些NO和![]() 标准状况
标准状况![]() 混合并通入足量水中,气体全部被吸收生成
混合并通入足量水中,气体全部被吸收生成![]() 。则该硝酸的物质的量浓度为
。则该硝酸的物质的量浓度为![]()
![]()
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有Na+、K+、NH4+、Ca2+、Cu2+、SO42—、SO32—、Cl-、Br-、CO32—中的若干种,离子浓度都为0.1 mol·L-1。往该溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成。某同学另取少量原溶液,设计并完成如图所示实验。则下列关于原溶液的判断正确的是( )
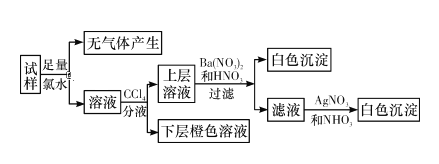
A.若实验中Ba(NO3)2和HNO3的混合溶液改用BaCl2和盐酸的混合溶液,对溶液中离子的判断无影响
B.无法确定原溶液中是否存在Cl-
C.原溶液中肯定存在的上述离子是SO32—、Br-,是否存在Na+、K+需要通过焰色反应来确定
D.原溶液中肯定不存在的上述离子是Ca2+、Cu2+、SO42—、CO32—,是否存在NH4+另需实验验证
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,①和②为两个体积相同的固定容器,图中“![]() ”和“
”和“![]() ”分别表示氢原子和氧原子,则下列说法正确的是( )
”分别表示氢原子和氧原子,则下列说法正确的是( )
①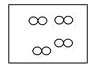 ②
②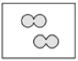
A.若①中的![]() 为4mol,则②中所含原子总数为
为4mol,则②中所含原子总数为![]() 个
个
B.①和②中气体的质量之比为1:8
C.![]() 、
、![]() 均能发生化合反应,但均不能发生置换反应
均能发生化合反应,但均不能发生置换反应
D.两容器的温度和压强均相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分中学化学常见元素原子结构及性质如下表所示
元素 | 结构及性质 |
A | 元素A在第三周期中简单离子半径最小 |
B | B原子最外层电子数是内层电子数的0.6 |
C | 使用最广泛的金属元素C能形成两种氯化物,其相对分子质量之差为35.5 |
D | 元素D与B同主族,且大多数情况下D不显正化合价 |
E | 元素E在周期表中位于ⅠA族,有人认为将其排在ⅦA族也有一定道理 |
F | 元素F与B同周期,其最高价氧化物的水化物与A或B的最高价氧化物的水化物均能反应 |
(1)元素C在周期表中的位置是____元素;元素E形成的一种简单离子能支持“将元素E排在ⅦA族”这一观点,该离子的结构示意图为___。
(2)元素E与D可以按原子个数比2∶1、1∶1形成两种化合物X、Y,区别X、Y这两种物质的实验方法为 __。E与B形成的一种化合物Z与X、Y中的一种电子总数相同且能发生化学反应,写出该反应的化学方程式:___(用相应化学式表示)。
(3)请画出化合物F2B2的电子式:_____,该化合物中含有的化学键类型是___。
(4)元素A与元素F相比,金属性较强的是_________ (用元素符号表示),下列表述正确且能证明这一事实的是___(填字母代号)。
a.对应单质与酸反应时,每个A原子比每个F原子失电子多
b.对应单质与同浓度盐酸反应时,F比A剧烈得多
c.A的氧化物熔点比F的氧化物熔点高
d.F可将A从其盐溶液中置换出来
e.最高价氧化物对应的水化物的碱性F比A的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机化工原料的结构简式如图所示,下列关于该有机物的说法正确的是( )
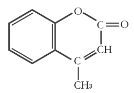
A.1 mol该物质最多能和5mol H2发生加成反应
B.能使酸性KMnO4溶液褪色,能发生加成反应和取代反应
C.该分子中所有原子都可能共平面
D.该物质的分子式为C10H10O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com