
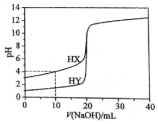
 常温下,用浓度为0.1000mol•L-1的NaOH溶液分别逐滴加入到20.00mL 0.1000mol•L-1的HX、HY溶液中,pH随NaOH溶液体积的变化如图.下列说法正确( )
常温下,用浓度为0.1000mol•L-1的NaOH溶液分别逐滴加入到20.00mL 0.1000mol•L-1的HX、HY溶液中,pH随NaOH溶液体积的变化如图.下列说法正确( )| A. | V(NaOH)=10.00 mL时,c(X-)>c(Na+)>c(H+)>c(OH-) | |
| B. | V(NaOH)=20.00 mL时,两份溶液中,c(X-)>c(Y-) | |
| C. | V(NaOH)=20.00 mL时,c(Na+)>c(X-)>c(OH-)>c(H+) | |
| D. | pH=7时,两份溶液中,c(X-)=c(Y-) |
分析 A、V(NaOH)=10.00 mL时,生成等物质的量浓度的HX和NaX,溶液呈酸性,以HX的电离为主;
B、由图可知V(NaOH)=20.00 mL时,两者恰好完全反应,HX的PH大于HY,所以NaX的水解程度大于NaY;
C、由图可知V(NaOH)=20.00 mL时,两者恰好完全反应,都生成强碱弱酸盐;
D、NaX的水解程度大于NaY,而pH=7时,两份溶液中第一份需氢氧化钠的物质的量少,根据电荷守恒,c(X-)>c(Y-).
解答 解:A、V(NaOH)=10.00 mL时,生成等物质的量浓度的HX和NaX,溶液呈酸性,以HX的电离为主,所以离子浓度的大小为:,c(X-)>c(Na+)>c(H+)>c(OH-),故A正确;
B、由图可知V(NaOH)=20.00 mL时,两者恰好完全反应,HX的PH大于HY,所以NaX的水解程度大于NaY,则两份溶液中,c(X-)<c(Y-),故B错误;
C、由图可知V(NaOH)=20.00 mL时,两者恰好完全反应,都生成强碱弱酸盐,水解呈碱性,所以离子浓度的大小为:c(Na+)>c(X-)>c(OH-)>c(H+),故C正确;
D、NaX的水解程度大于NaY,而pH=7时,两份溶液中第一份需氢氧化钠的物质的量少,根据电荷守恒,c(X-)>c(Y-),故D错误;
故选AC.
点评 本题考查了酸碱混合溶液定性判断,涉及弱电解质的电离、盐类水解、酸碱中和反应等知识点,根据弱电解质的电离特点、溶液酸碱性及盐类水解等知识点来分析解答,题目难度中等.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:解答题
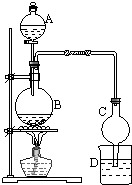 (1)某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中盛有浓硫酸,B中盛有乙醇、乙酸,D中盛有饱和碳酸钠溶液.
(1)某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中盛有浓硫酸,B中盛有乙醇、乙酸,D中盛有饱和碳酸钠溶液.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
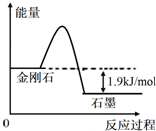 根据表中的信息判断下列说法错误的是( )
根据表中的信息判断下列说法错误的是( )| 物质 | 总键能/(kJ•mol-1) | 燃烧热/(kJ•mol-1) |
| 金刚石 | a | 395.4 |
| 石墨 | b | 393.5 |
| A. | 由表中信息可得如右图所示的图象 | |
| B. | 由表中信息知C(石墨,s)=C(金刚石,s)△H=+1.9kJ/mol | |
| C. | 由表中信息可推知a<b | |
| D. | 表示石墨燃烧热的热化学方程式为C(石墨,s)+1/2O2(g)═CO(g)△H=-393.5kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成物全部化学键形成时所释放的能量大于破坏反应物全部化学键所吸收的能量时,反应为放热反应 | |
| B. | 氢氧燃料电池使用时是将热能转化成电能 | |
| C. | 人们用氢氧焰焊接或切割金属,主要是利用了氢气和氧气化合时所放出的能量 | |
| D. | 太阳能光电池将太阳能直接转换为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用10 mL量筒量取7.13 mL盐酸 | |
| B. | 用广泛pH试纸测得某溶液的pH为2.3 | |
| C. | 用25ml酸式滴定管量取21.70 mLKMnO4溶液 | |
| D. | 用托盘天平称量25.20 g NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 保持温度不变,向平衡后的容器中再充入1molSO2和0.5molO2时,V(正)>V(逆) | |
| B. | 相同温度下,起始时向容器中充入2mol SO3,达平衡时SO3的转化率为20% | |
| C. | 平衡混合气体中SO2的物质的量为1.2mol | |
| D. | 保持其他条件不变,若起始时向容器中充入2molSO3,达平衡时吸收39.2kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
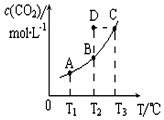 恒容密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g).CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法错误的是( )
恒容密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g).CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法错误的是( )| A. | 在T2时,若反应进行到状态D,则一定有v正<v逆 | |
| B. | 平衡状态A与C相比,平衡状态A的c(CO)小 | |
| C. | 若T1、T2时的平衡常数分别为K1、K2,则K1<K2 | |
| D. | 反应CO(g)+H2O(g)?CO2(g)+H2(g)的△H>0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com