
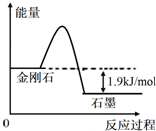
 根据表中的信息判断下列说法错误的是( )
根据表中的信息判断下列说法错误的是( )| 物质 | 总键能/(kJ•mol-1) | 燃烧热/(kJ•mol-1) |
| 金刚石 | a | 395.4 |
| 石墨 | b | 393.5 |
| A. | 由表中信息可得如右图所示的图象 | |
| B. | 由表中信息知C(石墨,s)=C(金刚石,s)△H=+1.9kJ/mol | |
| C. | 由表中信息可推知a<b | |
| D. | 表示石墨燃烧热的热化学方程式为C(石墨,s)+1/2O2(g)═CO(g)△H=-393.5kJ/mol |
分析 由表中的燃烧热可知,①C(金刚石,s)+O2(g)═CO2(g)△H=-395.4kJ/mol、②C(石墨,s)+O2(g)═CO2(g)△H=-393.5kJ/mol,②-①得C(石墨,s)=C(金刚石,s)△H=+1.9kJ/mol,可知金刚石是的能量高,以此来解答.
解答 解:由表中的燃烧热可知,①C(金刚石,s)+O2(g)═CO2(g)△H=-395.4kJ/mol、②C(石墨,s)+O2(g)═CO2(g)△H=-393.5kJ/mol,②-①得C(石墨,s)=C(金刚石,s)△H=+1.9kJ/mol,可知金刚石是的能量高,
A.金刚石转化为石墨为放热反应,可得如右图所示的图象,故A正确;
B.由上述分析可知,C(石墨,s)=C(金刚石,s)△H=+1.9kJ/mol,故B正确;
C.C(石墨,s)=C(金刚石,s)△H=+1.9kJ/mol,则b-a>0,即a<b,故C正确;
D.表示石墨燃烧热的热化学方程式为C(石墨,s)+O2(g)═CO2(g)△H=-393.5kJ/mol,故D错误;
故选D.
点评 本题考查反应热与焓变,为高频考点,把握燃烧热化学方程式、稳定氧化物及盖斯定律的应用为解答的关键,侧重分析与应用能力的考查,注意CO不是稳定氧化物,题目难度不大.


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:填空题
| 编号 | 0.1mol/L H2C2O4 溶液的体积/mL | 0.01mol/L 酸性 KMnO4 的体积/mL | 蒸馏水的体积/mL | 温度/℃ |
| ① | 2 | 4 | 2 | 25 |
| ② | 3 | |||
| ③ | 50 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
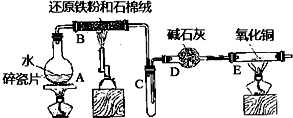
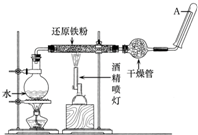 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应.应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气反应的实验”.
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应.应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气反应的实验”.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
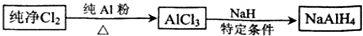
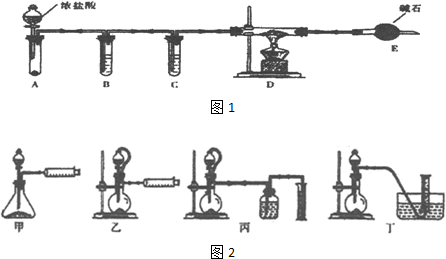
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
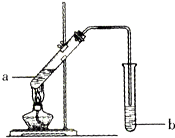 如图为实验室制备乙酸乙醋的装置.
如图为实验室制备乙酸乙醋的装置.| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 |
| 乙醇 | -114 | 78 | 0.789 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.900 |
| 浓H2SO4 | 338 | 1.84 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
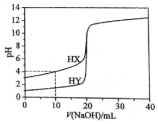 常温下,用浓度为0.1000mol•L-1的NaOH溶液分别逐滴加入到20.00mL 0.1000mol•L-1的HX、HY溶液中,pH随NaOH溶液体积的变化如图.下列说法正确( )
常温下,用浓度为0.1000mol•L-1的NaOH溶液分别逐滴加入到20.00mL 0.1000mol•L-1的HX、HY溶液中,pH随NaOH溶液体积的变化如图.下列说法正确( )| A. | V(NaOH)=10.00 mL时,c(X-)>c(Na+)>c(H+)>c(OH-) | |
| B. | V(NaOH)=20.00 mL时,两份溶液中,c(X-)>c(Y-) | |
| C. | V(NaOH)=20.00 mL时,c(Na+)>c(X-)>c(OH-)>c(H+) | |
| D. | pH=7时,两份溶液中,c(X-)=c(Y-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(HCO3)2 | B. | Na2S | C. | FeI2 | D. | AlCl3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com