
| A. | 充电时阳极反应式为:4Cl-+S+SO2-4e-═2SOCl2 | |
| B. | 电池的电解液可用LiCl水溶液代替 | |
| C. | 放电时电子从负极经电解液流向正极 | |
| D. | 该电池放电时,负极发生还原反应 |
分析 A.充电时,阳极上S失电子发生氧化反应;
B.水和Li发生反应生成LiOH和氢气;
C.电子只能在外电路的导线中流动,不会在电解质溶液中流动;
D.放电时,电子从负极沿导线流向正极.
解答 解:A.充电时,阳极上S失电子发生氧化反应,阳极反应式为:4Cl-+S+SO2-4e-=2SOCl2,故A正确;
B.Li是一种碱金属,比较活泼,能与H2O直接发生反应,因此该锂电池的电解液不能用LiCl水溶液代替LiAlCl4-SOCl2,故B错误;
C.放电时,Li是负极,另一个电极是正极,负极上失电子、正极上得电子,所以电子从负极沿导线流向正极,故C错误;
D.放电时Li元素化合价由0价变为+1价,发生氧化反应,故D错误;
故选A.
点评 本题考查了原电池、电解池工作原理,题目难度中等,明确原电池、电解池判断方法是解本题关键,难点是电极反应式的书写,要结合电池反应式及元素化合价变化书写.


科目:高中化学 来源:2016-2017学年江苏省高一上10月阶段测化学卷(解析版) 题型:选择题
下列实验操作的描述中,正确的是 ( )
A. 取用Na2CO3溶液时,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中
B. 用溶解、过滤的方法分离氯化钠和硝酸钾的混合物
C. 称量NaOH固体,先在天平两盘上放大小相等纸片,然后NaOH放在左盘纸片上称量
D. 利用丁达尔效应可以区别溶液和胶体
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol•L-1 | 0.08 | 0.14 | 0.18 | 0.2 | 0.2 | 0.2 |
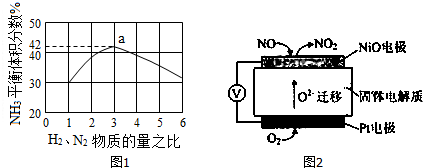
| 物质 | A | B | C | D |
| 起始投料/mol | 2 | 1 | 2 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用湿润的pH试纸测稀碱液的pH,测定值偏大 | |
| B. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 | |
| C. | 滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小 | |
| D. | 测定中和反应反的应热时,将碱缓慢倒入酸中,所测温度值偏大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将一铝箔放在酒精灯外焰上灼烧 | 铝箔熔化但不滴落 | 铝箔表面生成致密的Al2O3薄膜,且Al2O3熔点高于Al |
| B | 向某氯化亚铁溶液中加入Na2O2粉末 | 出现红褐色沉淀 | 加入Na2O2粉末前,原氯化 亚铁溶液已经变质 |
| C | 铜放入稀硫酸中,再加入硝酸钠固体 | 开始无明显现象,后溶液变蓝,有明显的气泡放出,铜溶解 | 硝酸钠可以加快铜与稀硫酸的反应速率 |
| D |  | 烧杯中有白色胶状沉淀生成 | 非金属性:N>C>Si |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
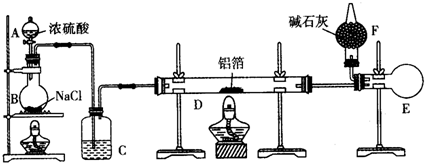
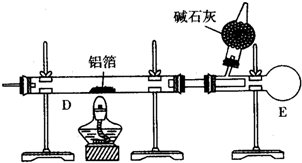
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 扩大铅蓄电池、汞锌锰干电池的生产,满足消费需求 | |
| B. | 采用碳捕集和储存技术,逐步实现二氧化碳的零排放 | |
| C. | 对工业废水、生活污水净化处理,减少污染物的排放 | |
| D. | 催化处理汽车尾气,减轻氮氧化物污染和光化学烟雾 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com