
【题目】下列反应中,生成物的总焓大于反应物总焓的是
A. 氢气在氧气中燃烧 B. 铁丝在氧气中燃烧
C. 硫在氧气中燃烧 D. 焦炭在高温下与水蒸气反应
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】常温下KMnO4氧化浓HCl的反应方程式如下:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
(1)用“双线桥法”标明反应中电子转移的方向和数目
(2)又已知MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,结合以上反应原理,则MnO2、KMnO4、Cl2的氧化性由强到弱的顺序是: .
MnCl2+Cl2↑+2H2O,结合以上反应原理,则MnO2、KMnO4、Cl2的氧化性由强到弱的顺序是: .
(3)浓盐酸在反应中显示出来的性质是 (填编号)
A只有还原性 B还原性和酸性 C只有氧化性 D氧化性和酸性
(4)若有63.2g高锰酸钾参加反应,则被氧化的HCl的物质的量为 mol,产生的Cl2在标准状况下的体积为 L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NH3催化还原氮的氧化物,可以消除氮的氧化物的污染。已知:
反应①:4NH3(g)+ 6NO(g)![]() 5N2(g) + 6H2O(l)
5N2(g) + 6H2O(l) ![]()
反应②:2NO(g) + O2(g) ![]() 2NO2(g)
2NO2(g) ![]() (
( ![]() < 0且
< 0且![]() =2
=2![]() )
)
反应③:4NH3(g) + 6NO2(g)![]() 5N2(g)+ 3O2 + 6H2O(l)
5N2(g)+ 3O2 + 6H2O(l) ![]()
反应①和反应②在不同温度时的平衡常数及其大小关心如下表:
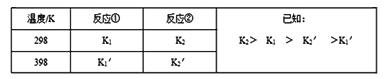
(1)试推测反应③是______ 反应(填“吸热”或“放热”)。
(2)相同条件下反应①在2L的密闭容器中选用不同的催化剂,反应产生N2的物质的量随时间的变化如图所示。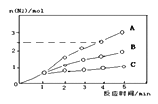
则:①计算0~4min时在A催化剂作用下,反应速率v(NO)=_______________
②下列说法正确的是:________________________
A.该反应的活化能大小顺序是:Ea(A)>Ea(B) >Ea(C)
B.增大压强能使反应速率加快的原因,是因为增加活化分子的百分数
C.单位时间内H-O键与N-H断裂的数目相等时,说明反应已达平衡状态
D.若在恒容绝热的密闭容器中进行,当温度不变时,说明反应已达平衡状态
(3)对于反应②,若在某温度下,在容积为2L的刚性密闭容器中起始加入2 molNO 和2 molO2,反应一段时间后,测的生成NO21.6mol,则该反应是否达到平衡状态?_________(填“是”或“不是”已知该温度下该反应的K约为147.3).达平衡后,在同一温度下向大小相同的另一刚性容器中加入1.2mol的NO2和1.5mol的O2,则还要加入NO______mol、O2_____mol,达平衡时各物质的浓度才能跟前平衡的相等。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积均为1.0 L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应CO2(g)+C(s) ![]() 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是( )
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是( )

A. 反应CO2(g)+C(s)===2CO(g)的ΔS>0、ΔH<0 B. 体系的总压强p总:p总(状态Ⅱ)= 2p总(状态Ⅰ)
C. 体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ) D. 逆反应速率v逆:v逆(状态Ⅰ)>v逆(状态Ⅲ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下提到的与盐的水解有关的说法是( )
①明矾可以做净水剂 ②实验室配制FeCl3溶液时,往往在FeCl3溶液中加入少量盐酸
③用NaHCO3和Al2(SO4)3两种溶液可作泡沫灭火剂 ④在NH4Cl溶液中加入金属镁会产生氢气
⑤草木灰与氨态氮肥不能混合施用 ⑥比较NH4Cl和Na2S等某些盐溶液的酸碱性
A. ①③⑥ B. ②③⑤ C. ③④⑤ D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.淀粉、纤维素、葡萄糖均能发生水解反应
B.使用青霉素前一定要进行皮肤敏感试验
C.利用油脂在碱性溶液中的水解可制取肥皂
D.甲醛,氯乙烯,乙二醇均可做聚合反应的单体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲、乙、丙和X是四种中学化学中常见的物质,其转化关系如下图,则甲和X不可能是( )

A. 甲为C,X是O2 B. 甲为SO2,X是NaOH溶液
C. 甲为Cl2,X为Fe D. 甲为Al,X为NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一种泉水,取0.5L这种泉水作为样品,经测定该样品中含有0.48g的Mg2+ . 那么,该泉水中Mg2+的物质的量的浓度是多少?为使该泉水样品所含的Mg2+全部沉淀,应加入1mol/L NaOH溶液的体积是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH=Q,其平衡常数随温度变化如下表所示:
CO2(g)+H2(g) ΔH=Q,其平衡常数随温度变化如下表所示:
温度/℃ | 400 | 500 | 850 |
平衡常数 | 9.94 | 9 | 1 |
请回答下列问题:
(1)上述反应的化学平衡常数表达式为 ,该反应的Q 0。
(2)850℃时在体积为10L反应器中,通入一定量的CO和H2O(g),发生上述反应,CO和H2O(g)浓度变化如图所示,则0~4min时平均反 应速率v(CO)= 。

(3)若在500 ℃时进行,且CO、H2O(g)的起始浓度均为0.020mol/L,该条件下,CO的最大转化率为 。
(4)若在850℃时进行,设起始时CO和H2O(g)共为1mol,其中水蒸气的体积分数为x平衡时CO的转化率为y,试推导y随x变化的函数关系式为 。
(5)某电化学装置可实现2CO2=2CO+O2的转化,使CO重复使用。已知该反应的阳极应为4OH--4e-=2H2O+O2,则阴极反应式为 。
(6)有人提出可以设计反应2CO=2C+O2(ΔH>0)来消除CO的污染,请判断上述反应能否发生 (填“可能”或“不可能”),理由是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com