
【题目】在体积均为1.0 L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应CO2(g)+C(s) ![]() 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是( )
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是( )

A. 反应CO2(g)+C(s)===2CO(g)的ΔS>0、ΔH<0 B. 体系的总压强p总:p总(状态Ⅱ)= 2p总(状态Ⅰ)
C. 体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ) D. 逆反应速率v逆:v逆(状态Ⅰ)>v逆(状态Ⅲ)
【答案】C
【解析】A.由气体的化学计量数增大可知△S>0,由图中温度高平衡时c(CO2)小,则升高温度平衡正向移动,可知△H>0,故A错误;B.分别加入0.1molCO2和0.2molCO2,曲线I为加入0.1molCO2,曲线II为加入0.2molCO2,若平衡不移动,体系的总压强为P总(状态Ⅱ)=2P总(状态Ⅰ),但加压CO2(g)+C(s) ![]() 2CO(g)平衡逆向移动,为使c(CO2)相同,则加热使平衡正向移动,则体系的总压强为P总(状态Ⅱ)>2P总(状态Ⅰ),故B错误;C.状态II、状态Ⅲ的温度相同,状态II看作先加入0.1molCO2,与状态Ⅲ平衡时CO的浓度相同,再加入0.1molCO2,若平衡不移动,Ⅱ状态CO的浓度等于Ⅲ的2倍,但再充入CO2,相当增大压强,平衡左移,消耗CO,则c(CO,状态Ⅱ)<2c(CO,状态Ⅲ),故C正确;D.状态I、状态Ⅲ的温度不同,温度高反应速率快,则逆反应速率为V逆(状态Ⅰ)<V逆(状态Ⅲ),故D错误;故选C。
2CO(g)平衡逆向移动,为使c(CO2)相同,则加热使平衡正向移动,则体系的总压强为P总(状态Ⅱ)>2P总(状态Ⅰ),故B错误;C.状态II、状态Ⅲ的温度相同,状态II看作先加入0.1molCO2,与状态Ⅲ平衡时CO的浓度相同,再加入0.1molCO2,若平衡不移动,Ⅱ状态CO的浓度等于Ⅲ的2倍,但再充入CO2,相当增大压强,平衡左移,消耗CO,则c(CO,状态Ⅱ)<2c(CO,状态Ⅲ),故C正确;D.状态I、状态Ⅲ的温度不同,温度高反应速率快,则逆反应速率为V逆(状态Ⅰ)<V逆(状态Ⅲ),故D错误;故选C。


科目:高中化学 来源: 题型:
【题目】判断下列概念的依据正确的是
A. 纯净物与混合物:是否仅含有一种元素
B. 溶液与胶体:本质不同的原因是能否发生丁达尔现象
C. 强电解质与弱电解质:溶液的导电能力大小
D. 氧化还原反应的本质:有电子的得失或偏移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将固体X投入过量Y中,能生成白色沉淀并放出一种无色气体,该气体能燃烧,且不易溶于水,则X和Y可能依次是
A. 钠和氯化铝溶液 B. 铝和烧碱溶液
C. 过氧化钠和氯化亚铁溶液 D. 锌和稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2H4是一种高效清洁的火箭燃料。0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。则下列热化学方程式中正确的是( )
A. 1/2N2H4(g)+1/2O2(g)===1/2N2(g)+H2O(g) ΔH=+267 kJ·mol-1
B. N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH =-534 kJ·mol-1
C. N2H4(g)+O2(g)===N2(g)+2H2O(l) ΔH =-534 kJ·mol-1
D. N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH =-133.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食用醋中含有乙酸。下列关于乙酸的说法正确的是( )
A. 结构简式为:C2H4O2
B. 分子式为:CH3COOH ,官能团为羧基
C. 具有酸的通性,可与金属Na反应生成H2
D. 分子中原子之间只存在单键是共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A. 摩尔是物质的量的单位,每摩尔物质含有阿伏加德罗常数个微粒。
B. 气体摩尔体积是指1 mol任何气体所占的体积约为22.4L。
C. 氧气的相对分子质量为32,氧气的摩尔质量也为 32g。
D. 1mol·L-1硫酸中含有NA个SO42-。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,生成物的总焓大于反应物总焓的是
A. 氢气在氧气中燃烧 B. 铁丝在氧气中燃烧
C. 硫在氧气中燃烧 D. 焦炭在高温下与水蒸气反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解硫酸钠溶液生产硫酸和烧碱的装置如图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1:2,下列有关说法正确的是(说明:阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)
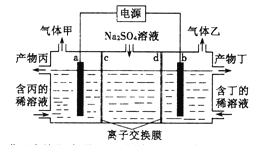
A. a电极反应式为:2H++2e—=H2↑ B. 产物丙为硫酸
C. d为阴离子交换膜 D. Na2SO4溶液浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.现有下列状态的物质①干冰 ②NaHCO3晶体 ③氨水 ④纯醋酸 ⑤FeCl3溶液 ⑥铜 ⑦熔融的KOH ⑧蔗糖
其中属于电解质的是___________ ,属于强电解质的是_____________。能导电的是___________。
Ⅱ.胶体是一种常见的分散系,回答下列问题。
①向煮沸的蒸馏水中逐滴加入___________溶液,继续煮沸至____________,停止加热,可制得Fe(OH)3胶体,制取Fe(OH)3胶体化学反应方程式为______________________________________________。
②向Fe(OH)3胶体中加入Na2SO4饱和溶液,由于_______离子(填离子符号)的作用,使胶体形成了沉淀,这个过程叫做_______________。
③区分胶体和溶液常用的方法叫做__________。
Ⅲ.①FeCl3溶液用作蚀刻铜箔制造电路板的工艺,离子方程式为_________________________。
②有学生利用FeCl3溶液制取FeCl36H2O晶体主要操作包括:滴入过量盐酸,______、冷却结晶、过滤。过滤操作除了漏斗、烧杯还需要什么玻璃仪器________________。
③高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,反应的离子方程式为___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com