
【题目】某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g) ![]() Z(g)+W(s);△H >0
Z(g)+W(s);△H >0
下列叙述正确的是
A. 减少少量W,逆反应速率减小
B. 当容器中气体的平均摩尔质量不变时,反应达到平衡
C. 降低温度,平衡正向移动
D. 平衡后加入Z,上述反应的△H减小
 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
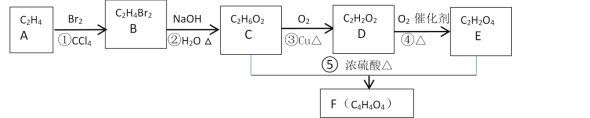
【题目】A的产量和质量是衡量一个国家石油化工发展水平高低一个重要标志,它也一种果实催熟剂。以A为原料合成一种含六元环结构F的流程路线图如图所示:
提示:R—CH2Br![]() R—CH2OH
R—CH2OH
回答下列问题:
(1)A的名称是___,分子的空间构型是___。反应①的化学反应类型是___;反应③的化学反应类型是___;反应⑤的化学反应类型是___;
(2)分别写出反应①、③、⑤的化学反应方程式:
①___;
③___;
⑤___。
(3)在浓硫酸、加热条件下,1molE与2molCH3CH2OH反应生成具有果香味的G,写出它的结构简式___。
(4)H是E的同系物,H与G互为同分异构体,H可能有___种结构。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁铝合金3.9g溶于200mL2mol·L1的盐酸,在标准状况下放出气体的体积为4.48L。向反应后的溶液中加入足量氨水,产生沉淀的质量为( )
A.3.9gB.9.0gC.10.7gD.12.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠和铝是两种重要的金属。请根据钠与铝的性质回答下列问题:
(1)将一小块金属钠投入水中,可观察到的实验现象是____________;
(2)钠在自然界中最主要的存在形式是__________;
(3)相同质量的钠在下列哪种情况下产生的氢气最多_________;
A.放在水中 B.放在足量盐酸中 C.放在足量CuSO4溶液中 D.用刺有小孔的铝箔包好放入足量水中
(4)铝分别与足量的NaOH溶液和盐酸反应,若两个反应在相同状况下放出等量的气体,则反应中消耗的NaOH和HCl物质的量之比为_________;
(5)常温下铝具有较强的抗腐蚀性,主要原因是__________;
(6)将铝片投入到下列溶液中,铝片不溶解的是______
A.NaOH溶液 B. NaCl溶液 C. H2SO4溶液 D.HCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素a、b、c、d的原子序数依次增大,在下列转化关系中,甲、乙、丙、丁、戊为上述四种元素组成的二元或三元化合物。其中A为d元素组成的单质,常温下乙为液体,丁物质常用于消毒、漂白。下列说法错误的是
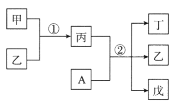
A.简单离子半径:c>b
B.丙中既有离子键又有极性键
C.b、c形成的化合物中阴、阳离子数目比为1:2
D.a、b、d形成的化合物中,d的杂化方式是sp3
查看答案和解析>>
科目:高中化学 来源: 题型:
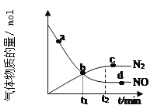
【题目】(1)氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g) + 4NH3(g)![]() 5N2(g) +6H2O(g)。
5N2(g) +6H2O(g)。
①能说明该反应已达到平衡状态的标志是____________
a.反应速率 v( NH3) =v( N2) b.容器内压强不再随时间而发生变化 c.容器内 N2 的物质的量分数不再随时间而发生变化 d.容器内 n(NO)∶n(NH3)∶n(N2)∶n(H2O) = 6∶4∶5∶6 e.12molN-H 键断裂的同时生成 5mol N≡N 键 f.混合气体的总质量不随时间的变化而变化
②某次实验中测得容器内 NO及N2的物质的量随时间变化如图所示,图中b点对应的速率关系是v(正) ___________ v(逆)(填﹥、﹤或﹦),d 点对应的速率关系是v(正) ___________ v(逆) (填﹥、﹤或﹦)。
(2) 已知:N≡N的键能为946kJ/mol, H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则N2与H2反应,生成1mol NH3过程中______(填“吸收”或“放出”)的能量为_______kJ。
(3) 一定条件下,在 5 L密闭容器内,反应 2NO2(g) ![]() N2O4(g) ΔH=-180 kJ·mol-1,n(NO2)随时间变化如下表:
N2O4(g) ΔH=-180 kJ·mol-1,n(NO2)随时间变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
①用 N2O4 表示 0~2 s 内该反应的平均速率为________ molL-1s-1。在第 5s 时,NO2 的转化率为___________。
②根据上表可以看出,随着反应进行,反应速率逐渐减小,其原因是______________。
③为加快反应速率,可以采取的措施是_______
a.升高温度 b.恒容时充入He气 c.恒压时充入He气 d.恒容时充入NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是重要的基础化工原料,可以制备尿素[CO(NH2)2]、N2H4等多种含氮的化工产品。
(1)以NH3与CO2为原料可以合成尿素[CO(NH2)2],涉及的化学反应如下:
反应I:2NH3(g)+CO2(g)![]() NH2CO2NH4(s) △H1= -159.5kJ·mol-1
NH2CO2NH4(s) △H1= -159.5kJ·mol-1
反应II:NH2CO2NH4(s)![]() CO(NH2)2(s)+H2O(g) △H2=+116.5kJmol-1
CO(NH2)2(s)+H2O(g) △H2=+116.5kJmol-1
反应III:H2O(l)=H2O(g) △H3=+44.0kJmol-1
则反应:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(l) △H=______kJmol-1
CO(NH2)2(s)+H2O(l) △H=______kJmol-1
(2)将氨气与二氧化碳在有催化剂的反应器中反应2NH3(g)+CO2(g)![]() CO(NH2)2 (s)+H2O(g),体系中尿素的产率和催化剂的活性与温度的关系如图1所示:
CO(NH2)2 (s)+H2O(g),体系中尿素的产率和催化剂的活性与温度的关系如图1所示:
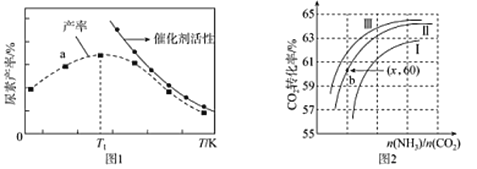
①a点_______(填是或不是)处于平衡状态,Tl之后尿素产率下降的原因是________。
②实际生产中,原料气带有水蒸气,图2表示CO2的转化率与氨碳比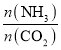 、水碳比
、水碳比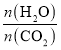 的变化关系。曲线I、II、III对应的水碳比最大的是_______,测得b点氨的转化率为30%,则x=___________。
的变化关系。曲线I、II、III对应的水碳比最大的是_______,测得b点氨的转化率为30%,则x=___________。
③已知该反应的v(正)=k(正)c2(NH3)c(CO2),v(逆)=k(逆)c(H2O),k(正)和k(逆)为速率常数,则平衡常数K与k(正)、k(逆)的关系式是___________。
(3)N2H4可作火箭推进剂。已知25℃时N2H4水溶液呈弱碱性:N2H4+H2O![]() N2H5++OH- K1=1×10-a;N2H5++H2O
N2H5++OH- K1=1×10-a;N2H5++H2O![]() N2H62++OH- K2=1×10一b。
N2H62++OH- K2=1×10一b。
①25 ℃时,向N2H4水溶液中加入H2SO4,欲使c(N2H5+)>c(N2H4),同时c(N2H5+)>c(N2H62+),应控制溶液pH范围__________(用含a、b式子表示)。
②水合肼(N2H4H2O)的性质类似一水合氨,与硫酸反应可以生成酸式盐,该盐的化学式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物H是一种治疗心血管疾病药物的中间体。一种合成H的路线:
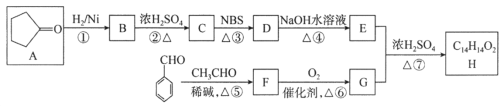
已知:信息① CH3CH2CH=CH2![]() CH3CHBrCH=CH2
CH3CHBrCH=CH2
信息② ![]()
回答下列问题:
(1)C的化学名称为________________,D中的官能团名称是__________________。
(2)②的反应类型是______________________________________。
(3)F的结构简式为______________________________________。
(4)写出由E和G生成H的化学方程式:__________________________________________。
(5)芳香族化合物Q是H的同分异构体,一定条件下,H和Q分别与足量H2加成,得到同一种产物,则Q的可能结构有________种(环中没有碳碳叁键,也没有连续的碳碳双键,不考虑立体结构),其中分子内存在碳碳叁键的同分异构体的结构简式为______________。
(6)呋喃丙烯酸(![]() )是一种医治血吸虫病的药物 呋喃丙胺的原料。设计以
)是一种医治血吸虫病的药物 呋喃丙胺的原料。设计以![]() 为原料合成呋喃丙烯酸的合成路线(无机试剂任选)。_____________。
为原料合成呋喃丙烯酸的合成路线(无机试剂任选)。_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向10mL0.1mol·L-1一元弱碱XOH溶液中逐滴滴加0.1mol·L-1的HCl溶液,溶液的AG![]() 变化如图所示(溶液混合时体积变化忽略不计)。下列说法不正确的是
变化如图所示(溶液混合时体积变化忽略不计)。下列说法不正确的是
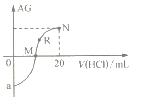
A. 若a=-8,则Kb(XOH)≈10-5
B. M点表示盐酸和XOH恰好完全反应
C. R点溶液中可能存在c(X+)+c(XOH)=c(Cl-)
D. M点到N点,水的电离程度先增大后减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com