
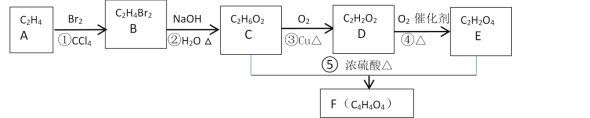
【题目】A的产量和质量是衡量一个国家石油化工发展水平高低一个重要标志,它也一种果实催熟剂。以A为原料合成一种含六元环结构F的流程路线图如图所示:
提示:R—CH2Br![]() R—CH2OH
R—CH2OH
回答下列问题:
(1)A的名称是___,分子的空间构型是___。反应①的化学反应类型是___;反应③的化学反应类型是___;反应⑤的化学反应类型是___;
(2)分别写出反应①、③、⑤的化学反应方程式:
①___;
③___;
⑤___。
(3)在浓硫酸、加热条件下,1molE与2molCH3CH2OH反应生成具有果香味的G,写出它的结构简式___。
(4)H是E的同系物,H与G互为同分异构体,H可能有___种结构。
【答案】乙烯 平面结构 加成反应 氧化反应 取代反应或酯化反应 CH2=CH2+Br2→BrCH2CH2Br HOCH2CH2OH+O2![]() OCH-CHO+2H2O
OCH-CHO+2H2O ![]()
![]() 2H2O+
2H2O+![]() CH3CH2OOC-COOCH2CH3 9
CH3CH2OOC-COOCH2CH3 9
【解析】
A的产量和质量是衡量一个国家石油化工发展水平高低一个重要标志,它也一种果实催熟剂,则A为乙烯,由A为原料合成一种含六元环结构F的流程路线图知,B为1,2-二溴乙烷,按信息知,1,2-二溴乙烷水解得到乙二醇,则C为乙二醇,D为乙二醛,E为乙二酸,F为乙二醇和乙二酸生成的酯,据此回答。
(1)据以上分析,A的名称是乙烯,分子的空间构型是平面结构,反应①为CH2=CH2+Br2→BrCH2CH2Br,是加成反应,反应③为乙二醇被催化氧化为乙二醛,则反应类型是氧化反应;反应⑤为乙二醇和乙二酸之间的酯化反应,也属于取代反应;
答案为:乙烯;平面结构;加成反应;氧化反应;取代反应或酯化反应;
(2)①为乙烯和溴之间的加成反应,则其化学反应方程式为:H2C=CH2+Br2→BrCH2CH2Br;
③为乙二醇被催化氧化为乙二醛,则其化学反应方程式为:HOCH2CH2OH+O2![]() OCH-CHO+2H2O;
OCH-CHO+2H2O;
⑤为乙二醇和乙二酸之间的酯化反应,因为生成六元环,故酯的结构简式为![]() ,则其化学反应方程式为:
,则其化学反应方程式为:![]()
![]() 2H2O+
2H2O+![]()
答案为:CH2=CH2+Br2→BrCH2CH2Br;HOCH2CH2OH+O2![]() OCH-CHO+2H2O;
OCH-CHO+2H2O;![]()
![]() 2H2O+
2H2O+![]() ;
;
(3)在浓硫酸、加热条件下,1molE即HOOC-COOH与2molCH3CH2OH反应生成具有果香味的G,则它的结构简式为CH3CH2OOC-COOCH2CH3;
答案为:CH3CH2OOC-COOCH2CH3;
(4)已知 H是E的同系物、H与G互为同分异构体,因为E为乙二酸,所以H也是二元羧酸,因为G结构简式为CH3CH2OOC-COOCH2CH3,则H的分子式为C6H10O4,则H可能为: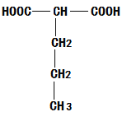 、
、 、
、 、HOOCC(CH3)2CH2COOH、
、HOOCC(CH3)2CH2COOH、
HOOCCH(CH3)CH(CH3)COOH、HOOCCH(C2H5)CH2COOH、HOOCCH(CH3) CH2CH2COOH、HOOCCH2CH(CH3)CH2COOH、HOOC(CH2)4COOH,共9种;。
答案为:9。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】室温下,下列溶液中微粒的物质的量浓度关系正确的是
A. 新制氯水中:c(H+)=c(HClO)+2c(ClO-)+c(OH-)
B. pH=8的NaClO2溶液中:c(Na+)>c(ClO2-)>c(OH-)>c(H+)
C. 0.1mol·L-1HCl溶液与0.2 mol·L-1 NH3·H2O溶液等体积混合pH>7:c(NH3·H2O)>c(Cl-)>c(NH4+)>c(OH-)
D. 0.1mol·L-1K2C2O4溶液与0.2 mol·L-1KHC2O4溶液等体积混合:4c(K+)=3[c(C2O42-)+c(HC2O4-)+c(H2C2O4) ]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为0.1 mol·L-1、体积均为100 mL的两种一元酸HX、HY的溶液中,分别加入NaOH固体,lg[c(H+)/c(OH-)]随加入NaOH的物质的量的变化如图所示。下列叙述正确的是( )
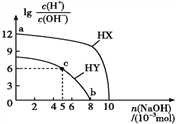
A. HX的酸性弱于HY B. c点溶液中:c(Y-)>c(HY)
C. a点由水电离出的c(H+)=10-12 mol·L-1 D. b点时酸碱恰好完全中和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,把4molA和5molB混合充入容积为2L的恒容密闭容器里,发生如下反应:4A(g)+5B(g)![]() xC(g)+6D(g),经5s反应达平衡,在此5s内C的平均反应速率为0.24mol·L-1·s-1,同时生成3.6molD,下列叙述中错误的是( )
xC(g)+6D(g),经5s反应达平衡,在此5s内C的平均反应速率为0.24mol·L-1·s-1,同时生成3.6molD,下列叙述中错误的是( )
A.达到平衡状态时C的产率为60%
B.x=4
C.只要混合气体的密度保持不变,就一定达到化学平衡状态
D.达到平衡状态时容器内气体的压强与起始时压强比为16:15
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、C同周期,A、D同主族,A、C能形成两种液态化合物A2C和A2C2,E元素的周期序数与主族序数相等,元素F与C形成一种具有磁性的物质G。
(1)F元素在周期表中的位置为___;BC2的电子式为___。
(2)由A、B两种元素组成的18电子微粒的分子式为___。
(3)上述元素的气态氢化物中,稳定性最强的是___(填化学式,下同);最高价氧化物对应的水化物是两性化合物的是___,其受热分解后的固态产物可溶于D的最高价氧化物对应的水化物中,其化学方程式为___。
(4)废印刷电路板上含有铜,用A2C2和稀硫酸浸泡废印刷电路板可以溶解铜,写出反应的离子方程式___;写出G与稀硝酸加热反应的离子方程式___。
(5)元素D的单质在一定条件下,能与A单质化合生成一种离子化合物DA,熔点为800℃,若将1molDA和1molE单质混合加入足量的水,充分反应后生成的气体在标准状况下的体积是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.0.1molNa2O2所含的离子总数是0.4NA
B.0.1mol的11B中,含有0.6NA个中子
C.常温常压下,124gP4中所含P—P键数目为4NA
D.密闭容器中,2molSO2和1molO2催化反应后分子总数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料,在催化剂作用下可发生反应:2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g),在50 ℃和70 ℃ K时SiHCl3的转化率随时间变化的结果如图所示。
SiH2Cl2(g)+SiCl4(g),在50 ℃和70 ℃ K时SiHCl3的转化率随时间变化的结果如图所示。
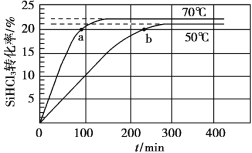
下列叙述不正确的是
A.该反应为吸热反应
B.反应速率大小:va >vb
C.70 ℃时,平衡常数K =0.112/0.782
D.增大压强,可以提高SiHCl3的平衡转化率,缩短达平衡的时间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列物质进行分类:①![]() H与
H与![]() H②O2与O3③乙醇与二甲醚(CH3-O-CH3)④CH3CH2CH2CH3与
H②O2与O3③乙醇与二甲醚(CH3-O-CH3)④CH3CH2CH2CH3与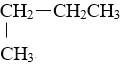 ⑤C60与C70
⑤C60与C70
(1)互为同位素的是______(填编号,下同);
(2)互为同素异形体的是______
(3)互为同分异构体的是______
(4)属于同一种物质的是________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g) ![]() Z(g)+W(s);△H >0
Z(g)+W(s);△H >0
下列叙述正确的是
A. 减少少量W,逆反应速率减小
B. 当容器中气体的平均摩尔质量不变时,反应达到平衡
C. 降低温度,平衡正向移动
D. 平衡后加入Z,上述反应的△H减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com