
【题目】三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料,在催化剂作用下可发生反应:2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g),在50 ℃和70 ℃ K时SiHCl3的转化率随时间变化的结果如图所示。
SiH2Cl2(g)+SiCl4(g),在50 ℃和70 ℃ K时SiHCl3的转化率随时间变化的结果如图所示。
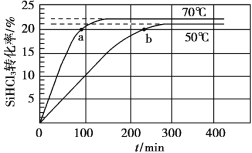
下列叙述不正确的是
A.该反应为吸热反应
B.反应速率大小:va >vb
C.70 ℃时,平衡常数K =0.112/0.782
D.增大压强,可以提高SiHCl3的平衡转化率,缩短达平衡的时间
科目:高中化学 来源: 题型:
【题目】一定温度下在一容积不变的密闭容器中发生可逆反应2X(g) ![]() Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是( )
Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是( )
A. 混合气体的密度不再变化 B. 反应容器中Y的质量分数不变
C. X的分解速率与Y的消耗速率相等 D. 单位时间内生成1 mol Y的同时生成2 mol X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂利用工业废水M(含有MgSO4、NaCl、MnSO4)为原料制备氮镁磷复合肥MAP,其生成流程如图所示:
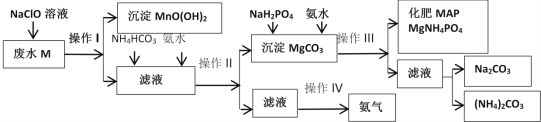
回答下列问题:
(1)实验室中,操作I、II、III为过滤,过滤所需的玻璃仪器有___;若发现滤液浑浊,可能的原因是___;洗涤沉淀的操作是___。
(2)废水M中加入NaClO溶液发生反应的离子方程式为___。
(3)化工生产中,若针对操作IV,欲获得氨气,用于化工生产循环利用,该操作为___。
(4)化肥MAP生产过程中,加入NaH2PO4和氨水,此时氨水的作用是___。
(5)写出操作III中形成化肥MAP的化学反应方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A的产量和质量是衡量一个国家石油化工发展水平高低一个重要标志,它也一种果实催熟剂。以A为原料合成一种含六元环结构F的流程路线图如图所示:
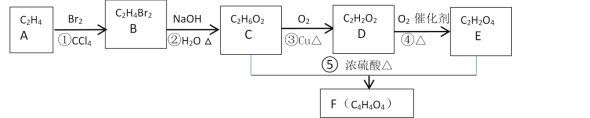
提示:R—CH2Br![]() R—CH2OH
R—CH2OH
回答下列问题:
(1)A的名称是___,分子的空间构型是___。反应①的化学反应类型是___;反应③的化学反应类型是___;反应⑤的化学反应类型是___;
(2)分别写出反应①、③、⑤的化学反应方程式:
①___;
③___;
⑤___。
(3)在浓硫酸、加热条件下,1molE与2molCH3CH2OH反应生成具有果香味的G,写出它的结构简式___。
(4)H是E的同系物,H与G互为同分异构体,H可能有___种结构。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知一定质量的锌粒与稀盐酸反应,生成H2的浓度与反应时间的关系如图所示,下列结论不正确的是
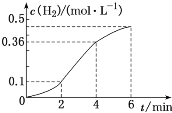
A.若将锌粒改为锌粉,可加快产生H2的反应速率
B.反应前4min内温度对反应速率的影响比浓度大
C.反应开始2min内平均反应速率最大
D.反应前4min内生成H2的平均速率v(H2)=0.09mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列叙述正确的是( )
A. 60g丙醇中存在的共价键总数为10NA
B. 1L 0.1mol·L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA
C. 钠在空气中燃烧可生成多种氧化物。23g钠充分燃烧时转移电子数为1NA
D. 235g核互U![]() 发生裂变反应:
发生裂变反应:![]() +
+![]() n
n![]()
![]() +
+![]() +10
+10![]() n,净产生的中子(
n,净产生的中子(![]() n)数为10NA
n)数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. 向稀HNO3中滴加NaHSO3溶液:H++HSO![]() ===SO2↑+H2O
===SO2↑+H2O
B. 硫酸铝溶液中加入过量氨水:Al3++3OH-===Al(OH)3↓
C. 向含有2 mol FeI2的溶液中通入2.5 mol Cl2:8I-+2Fe2++5Cl2===10Cl-+4I2+2Fe3+
D. 用酸性高锰酸钾标准溶液滴定草酸:2MnO![]() +16H++5C2O
+16H++5C2O![]() ===2Mn2++10CO2↑+8H2O
===2Mn2++10CO2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁铝合金3.9g溶于200mL2mol·L1的盐酸,在标准状况下放出气体的体积为4.48L。向反应后的溶液中加入足量氨水,产生沉淀的质量为( )
A.3.9gB.9.0gC.10.7gD.12.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是重要的基础化工原料,可以制备尿素[CO(NH2)2]、N2H4等多种含氮的化工产品。
(1)以NH3与CO2为原料可以合成尿素[CO(NH2)2],涉及的化学反应如下:
反应I:2NH3(g)+CO2(g)![]() NH2CO2NH4(s) △H1= -159.5kJ·mol-1
NH2CO2NH4(s) △H1= -159.5kJ·mol-1
反应II:NH2CO2NH4(s)![]() CO(NH2)2(s)+H2O(g) △H2=+116.5kJmol-1
CO(NH2)2(s)+H2O(g) △H2=+116.5kJmol-1
反应III:H2O(l)=H2O(g) △H3=+44.0kJmol-1
则反应:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(l) △H=______kJmol-1
CO(NH2)2(s)+H2O(l) △H=______kJmol-1
(2)将氨气与二氧化碳在有催化剂的反应器中反应2NH3(g)+CO2(g)![]() CO(NH2)2 (s)+H2O(g),体系中尿素的产率和催化剂的活性与温度的关系如图1所示:
CO(NH2)2 (s)+H2O(g),体系中尿素的产率和催化剂的活性与温度的关系如图1所示:
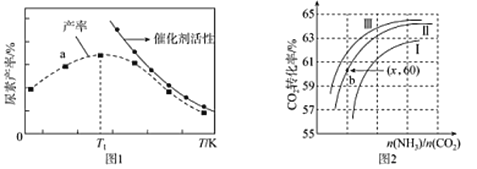
①a点_______(填是或不是)处于平衡状态,Tl之后尿素产率下降的原因是________。
②实际生产中,原料气带有水蒸气,图2表示CO2的转化率与氨碳比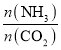 、水碳比
、水碳比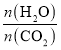 的变化关系。曲线I、II、III对应的水碳比最大的是_______,测得b点氨的转化率为30%,则x=___________。
的变化关系。曲线I、II、III对应的水碳比最大的是_______,测得b点氨的转化率为30%,则x=___________。
③已知该反应的v(正)=k(正)c2(NH3)c(CO2),v(逆)=k(逆)c(H2O),k(正)和k(逆)为速率常数,则平衡常数K与k(正)、k(逆)的关系式是___________。
(3)N2H4可作火箭推进剂。已知25℃时N2H4水溶液呈弱碱性:N2H4+H2O![]() N2H5++OH- K1=1×10-a;N2H5++H2O
N2H5++OH- K1=1×10-a;N2H5++H2O![]() N2H62++OH- K2=1×10一b。
N2H62++OH- K2=1×10一b。
①25 ℃时,向N2H4水溶液中加入H2SO4,欲使c(N2H5+)>c(N2H4),同时c(N2H5+)>c(N2H62+),应控制溶液pH范围__________(用含a、b式子表示)。
②水合肼(N2H4H2O)的性质类似一水合氨,与硫酸反应可以生成酸式盐,该盐的化学式为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com