
【题目】某化工厂利用工业废水M(含有MgSO4、NaCl、MnSO4)为原料制备氮镁磷复合肥MAP,其生成流程如图所示:
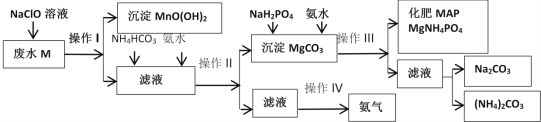
回答下列问题:
(1)实验室中,操作I、II、III为过滤,过滤所需的玻璃仪器有___;若发现滤液浑浊,可能的原因是___;洗涤沉淀的操作是___。
(2)废水M中加入NaClO溶液发生反应的离子方程式为___。
(3)化工生产中,若针对操作IV,欲获得氨气,用于化工生产循环利用,该操作为___。
(4)化肥MAP生产过程中,加入NaH2PO4和氨水,此时氨水的作用是___。
(5)写出操作III中形成化肥MAP的化学反应方程式为___。
【答案】漏斗、烧杯、玻璃棒 滤纸破损(或滤液液面超过滤纸的边缘等) 用玻璃棒引流,向过滤器中注入蒸馏水至浸没沉淀,待水流完后,重复操作2~3遍 ClO-+Mn2++2OH-=MnO(OH)2↓+Cl- 加入生石灰、加热 充当反应物,消耗溶液中的H+,调节溶液的pH 2NaH2PO4+4NH3·H2O+2MgCO3=2MgNH4PO4+Na2CO3+(NH4)2CO3+4H2O
【解析】
由流程知,工业废水M(含有MgSO4、NaCl、MnSO4)中加入NaClO溶液,MnSO4被氧化为MnO(OH)2沉淀,经过滤后分离,所得滤液中含MgSO4、NaCl等,滤液中加入碳酸氢铵和氨水,调 pH产生MgCO3沉淀,经操作Ⅱ即过滤后分离出MgCO3沉淀和滤液,滤液中含铵盐,则操作Ⅳ是把铵盐转变为氨气的过程,而往MgCO3沉淀中加入NaH2PO4和氨水,NaH2PO4呈酸性和MgCO3、氨水发生反应生成化肥MAP,操作Ⅲ的滤液含钠离子、铵离子和碳酸根,可进一步提取出碳酸钠和碳酸铵,据此回答;
(1)过滤所需的玻璃仪器有漏斗、烧杯、玻璃棒;若发现滤液浑浊,可能的原因是滤纸破损(或滤液液面超过滤纸的边缘等);洗涤沉淀的操作是:用玻璃棒引流,向过滤器中注入蒸馏水至浸没沉淀,待水流完后,重复操作2~3遍;
(2)废水M中加入NaClO溶液,发生氧化还原反应,NaClO溶液有强氧化性,把Mn2+氧化了,则反应的离子方程式为ClO-+Mn2++2OH-=MnO(OH)2↓+Cl-;
(3)操作Ⅳ是把铵盐转变为氨气的过程,欲获得氨气,则在加热条件下铵盐需要和强碱反应,那么最价廉物美又来源广泛的,就是加生石灰,故该操作为加入生石灰、加热;
(4)MgCO3沉淀中加入NaH2PO4和氨水,此时氨水的作用是充当反应物,消耗溶液中的H+,调节溶液的pH,以得到MgNH4PO4;
(5)操作III中,NaH2PO4、NH3·H2O和MgCO3反应,得到MgNH4PO4外,还有Na2CO3和(NH4)2CO3等,则该化学反应方程式为:2NaH2PO4+4NH3·H2O+2MgCO3=2MgNH4PO4+Na2CO3+(NH4)2CO3+4H2O。


科目:高中化学 来源: 题型:
【题目】下列过程的能量变化符合下图所示的是
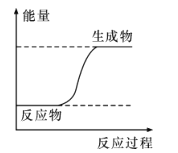
A. 酸碱中和反应
B. CH4在O2中燃烧
C. NH4Cl晶体与Ba(OH)28H2O晶体混合搅拌
D. CaO溶于水生成Ca(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学向SO2和Cl2的混合气体中加入品红溶液,振荡,溶液褪色,将此无色溶液分成三份,依次进行实验,实验操作和实验现象记录如下:
序号 | |||
实验操作 |
|
|
|
实验现象 | 溶液不变红,试纸不变蓝 | 溶液不变红,试纸褪色 | 生成白色沉淀 |
下列实验分析中,不正确的是
A. ①说明Cl2被完全消耗
B. ②中试纸褪色的原因是:SO2 + I2 + 2H2O == H2SO4 + 2HI
C. ③中若将BaCl2溶液换成Ba(NO3)2溶液,也能说明SO2被Cl2氧化为SO42
D. 实验条件下,品红溶液和SO2均被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为0.1 mol·L-1、体积均为100 mL的两种一元酸HX、HY的溶液中,分别加入NaOH固体,lg[c(H+)/c(OH-)]随加入NaOH的物质的量的变化如图所示。下列叙述正确的是( )
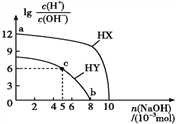
A. HX的酸性弱于HY B. c点溶液中:c(Y-)>c(HY)
C. a点由水电离出的c(H+)=10-12 mol·L-1 D. b点时酸碱恰好完全中和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸甲酯是调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精,用于肥皂、洗涤剂、风味剂和糕点的调味,在医药工业中作为有机合成的中间体.合成肉桂酸甲酯的工业流程如下图所示:
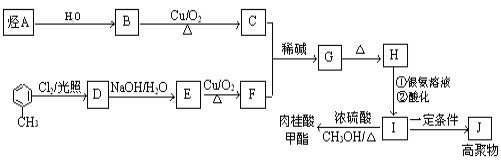
已知:I.醛与醛能发生反应,原理如下:
![]()
Ⅱ.烃A在标准状况下的密度为1.25 g/L.
请回答:
(1)化合物H中的官能团为_____________________________。
(2)肉桂酸甲酯的结构简式为__________________,J的结构简式为________________。
(3)G→H的反应类型为______________________。
(4)写出反应H发生银镜反应的化学方程式_______________,H→I的反应________________(填“能”或“不能”)改用酸性高锰酸钾溶液,简述理由_______________________________________。
(5)符合下列条件的I的同分异构体共有5种。写出另两种同分异构体的结构简式:
A.能发生水解反应
B.与银氨溶液作用出现光亮的银镜
C.能与溴发生加成
 、_____________、_____________。
、_____________、_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,把4molA和5molB混合充入容积为2L的恒容密闭容器里,发生如下反应:4A(g)+5B(g)![]() xC(g)+6D(g),经5s反应达平衡,在此5s内C的平均反应速率为0.24mol·L-1·s-1,同时生成3.6molD,下列叙述中错误的是( )
xC(g)+6D(g),经5s反应达平衡,在此5s内C的平均反应速率为0.24mol·L-1·s-1,同时生成3.6molD,下列叙述中错误的是( )
A.达到平衡状态时C的产率为60%
B.x=4
C.只要混合气体的密度保持不变,就一定达到化学平衡状态
D.达到平衡状态时容器内气体的压强与起始时压强比为16:15
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、C同周期,A、D同主族,A、C能形成两种液态化合物A2C和A2C2,E元素的周期序数与主族序数相等,元素F与C形成一种具有磁性的物质G。
(1)F元素在周期表中的位置为___;BC2的电子式为___。
(2)由A、B两种元素组成的18电子微粒的分子式为___。
(3)上述元素的气态氢化物中,稳定性最强的是___(填化学式,下同);最高价氧化物对应的水化物是两性化合物的是___,其受热分解后的固态产物可溶于D的最高价氧化物对应的水化物中,其化学方程式为___。
(4)废印刷电路板上含有铜,用A2C2和稀硫酸浸泡废印刷电路板可以溶解铜,写出反应的离子方程式___;写出G与稀硝酸加热反应的离子方程式___。
(5)元素D的单质在一定条件下,能与A单质化合生成一种离子化合物DA,熔点为800℃,若将1molDA和1molE单质混合加入足量的水,充分反应后生成的气体在标准状况下的体积是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料,在催化剂作用下可发生反应:2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g),在50 ℃和70 ℃ K时SiHCl3的转化率随时间变化的结果如图所示。
SiH2Cl2(g)+SiCl4(g),在50 ℃和70 ℃ K时SiHCl3的转化率随时间变化的结果如图所示。
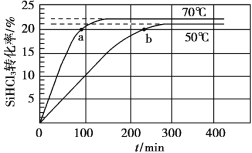
下列叙述不正确的是
A.该反应为吸热反应
B.反应速率大小:va >vb
C.70 ℃时,平衡常数K =0.112/0.782
D.增大压强,可以提高SiHCl3的平衡转化率,缩短达平衡的时间
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com