
【题目】下列指定反应的离子方程式正确的是( )
A. 向稀HNO3中滴加NaHSO3溶液:H++HSO![]() ===SO2↑+H2O
===SO2↑+H2O
B. 硫酸铝溶液中加入过量氨水:Al3++3OH-===Al(OH)3↓
C. 向含有2 mol FeI2的溶液中通入2.5 mol Cl2:8I-+2Fe2++5Cl2===10Cl-+4I2+2Fe3+
D. 用酸性高锰酸钾标准溶液滴定草酸:2MnO![]() +16H++5C2O
+16H++5C2O![]() ===2Mn2++10CO2↑+8H2O
===2Mn2++10CO2↑+8H2O
【答案】C
【解析】
A.向稀HNO3中滴加Na2SO3溶液,二者发生氧化还原反应,正确的离子反应为:2NO3-+3SO32-+2H+═3SO42-+2NO↑+H2O,故A错误;
B.硫酸铝溶液中加入过量氨水,二者反应生成氢氧化铝沉淀和硫酸铵,一水合氨为弱碱,不能拆开,应写化学式,正确的离子方程式:Al3++3NH3·H2O═Al(OH)3↓+3NH4+,故B错误;
C.向含有2molFeI2的溶液中通入2.5molCl2,4molI-消耗2molCl2,剩余的0.5mol氯气氧化1mol亚铁离子,该反应的离子方程式为:8I-+2Fe2++5Cl2=10Cl-+4I2+2Fe3+,故C正确;
D.用酸性高锰酸钾标准溶液滴定草酸,草酸是弱酸,应写化学式,正确的离子方程式为:2MnO4-+6H++5H2C2O4=2Mn2++10CO2↑+8H2O,故D错误。
故选C。


科目:高中化学 来源: 题型:
【题目】某同学向SO2和Cl2的混合气体中加入品红溶液,振荡,溶液褪色,将此无色溶液分成三份,依次进行实验,实验操作和实验现象记录如下:
序号 | |||
实验操作 |
|
|
|
实验现象 | 溶液不变红,试纸不变蓝 | 溶液不变红,试纸褪色 | 生成白色沉淀 |
下列实验分析中,不正确的是
A. ①说明Cl2被完全消耗
B. ②中试纸褪色的原因是:SO2 + I2 + 2H2O == H2SO4 + 2HI
C. ③中若将BaCl2溶液换成Ba(NO3)2溶液,也能说明SO2被Cl2氧化为SO42
D. 实验条件下,品红溶液和SO2均被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、C同周期,A、D同主族,A、C能形成两种液态化合物A2C和A2C2,E元素的周期序数与主族序数相等,元素F与C形成一种具有磁性的物质G。
(1)F元素在周期表中的位置为___;BC2的电子式为___。
(2)由A、B两种元素组成的18电子微粒的分子式为___。
(3)上述元素的气态氢化物中,稳定性最强的是___(填化学式,下同);最高价氧化物对应的水化物是两性化合物的是___,其受热分解后的固态产物可溶于D的最高价氧化物对应的水化物中,其化学方程式为___。
(4)废印刷电路板上含有铜,用A2C2和稀硫酸浸泡废印刷电路板可以溶解铜,写出反应的离子方程式___;写出G与稀硝酸加热反应的离子方程式___。
(5)元素D的单质在一定条件下,能与A单质化合生成一种离子化合物DA,熔点为800℃,若将1molDA和1molE单质混合加入足量的水,充分反应后生成的气体在标准状况下的体积是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料,在催化剂作用下可发生反应:2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g),在50 ℃和70 ℃ K时SiHCl3的转化率随时间变化的结果如图所示。
SiH2Cl2(g)+SiCl4(g),在50 ℃和70 ℃ K时SiHCl3的转化率随时间变化的结果如图所示。
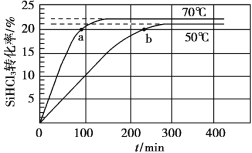
下列叙述不正确的是
A.该反应为吸热反应
B.反应速率大小:va >vb
C.70 ℃时,平衡常数K =0.112/0.782
D.增大压强,可以提高SiHCl3的平衡转化率,缩短达平衡的时间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2资源化利用的方法之一是合成二甲醚(CH3OCH3)。
(1)CO2 催化加氢合成二甲醚的过程中主要发生下列反应:反应I:CO2(g) + H2(g) ![]() CO(g) + H2O(g) H= +41.2 kJmol-1;反应II: 2CO2(g) + 6H2(g)
CO(g) + H2O(g) H= +41.2 kJmol-1;反应II: 2CO2(g) + 6H2(g) ![]() CH3OCH3(g) + 3H2O(g) H = - 122.5 kJmol-1;其中,反应II 分以下①②两步完成,请写出反应①的热化学方程式。
CH3OCH3(g) + 3H2O(g) H = - 122.5 kJmol-1;其中,反应II 分以下①②两步完成,请写出反应①的热化学方程式。
① _____
②2 CH3OH(g) ![]() CH3OCH3(g) + H2O(g) H = -23.5 kJmol-1
CH3OCH3(g) + H2O(g) H = -23.5 kJmol-1
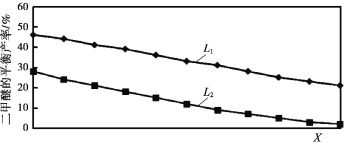
(2)L(L1、L2)、X分别代表压强或温度,如图表示L一定时,反应II中二甲醚的平衡产率随X变化的关系,其中X代表的物理量是_____。判断L1、L2的大小,并简述理由:_____。
(3)恒压时,在CO2和H2起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性![]() )随温度变化如图。
)随温度变化如图。
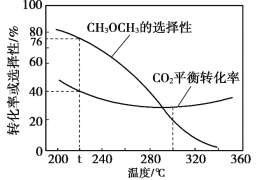
①t ℃ 时,起始投入a molCO2,b mol H2,达到平衡时反应II消耗的H2的物质的量为______mol。
②温度高于300℃,CO2平衡转化率随温度升高而增大的原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列物质进行分类:①![]() H与
H与![]() H②O2与O3③乙醇与二甲醚(CH3-O-CH3)④CH3CH2CH2CH3与
H②O2与O3③乙醇与二甲醚(CH3-O-CH3)④CH3CH2CH2CH3与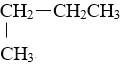 ⑤C60与C70
⑤C60与C70
(1)互为同位素的是______(填编号,下同);
(2)互为同素异形体的是______
(3)互为同分异构体的是______
(4)属于同一种物质的是________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.CO2是重要的化工原料,也是应用广泛的化工产品。CO2与过氧化钠或超氧化钾反应可产生氧气。完成下列计算:
(1)CO2通入氨水生成NH4HCO3,NH4HCO3很容易分解。2.00mol NH4HCO3完全分解,分解产物经干燥后的体积为_________L(标准状况)。
(2)某H2中含有2.40 molCO2,该混合气体通入2.00 L NaOH溶液中,CO2被完全吸收。如果NaOH完全反应,该NaOH溶液的浓度为_______。
(3)CO2和KO2有下列反应:
4KO2+2CO2→2K2CO3+3O2 4KO2+4CO2+2H2O→4KHCO3+3O2
若9 mol CO2在密封舱内和KO2反应后生成9 molO2,则反应前密封舱内H2O的量应该是______________。
(4)甲烷和水蒸气反应的产物是合成甲醇的原料:CH4+H2O![]() CO+3H2
CO+3H2
已知:CO+2H2![]() CH3OH CO2+3H2
CH3OH CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
300 mol CH4完全反应后的产物中,加入100 mol CO2后合成甲醇。若获得甲醇350 mol,残留氢气120 mol,计算CO2的转化率_______
Ⅱ.氨碱法制纯碱包括石灰石分解、粗盐水精制、氨盐水碳酸化等基本步骤。完成下列计算:
(5)CaCO3质量分数为0.90的石灰石100 kg完成分解产生CO2_______L(标准状况)。石灰窑中,该石灰石100 kg与焦炭混合焙烧,产生CO2 29120 L(标准状况),如果石灰石中碳酸钙完全分解,且焦炭完全燃烧,不产生CO,则焦炭的物质的量为_______mol。
(6)已知粗盐水含MgCl2 6.80 mol/m3,含CaCl2 3.00mol/m3。向粗盐水中加入Ca(OH)2除镁离子:MgCl2 + Ca(OH)2 → Mg(OH)2↓ + CaCl2然后加入Na2CO3除钙离子。处理上述粗盐水10 m3,至少需要加Na2CO3______g。如果用碳酸化尾气(含NH3体积分数为0.100、CO2体积分数0.040)代替碳酸钠,发生如下反应:Ca2+ + 2NH3 + CO2 + H2O → CaCO3↓ + 2NH4+处理上述10 m3粗盐水至少需要通入_____________L(标准状况)碳酸化尾气。
(7)某氨盐水含氯化钠1521 kg,通入二氧化碳后析出碳酸氢钠晶体,过滤后溶液中含氯化铵1070 kg。
①过滤后溶液中氯化钠的质量______________。
②析出的碳酸氢钠晶体的质量__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。

下列说法不正确的是
A. 生成CH3COOH总反应的原子利用率为100%
B. CH4→CH3COOH过程中,有C―H键发生断裂
C. ①→②放出能量并形成了C―C键
D. 该催化剂可有效提高反应物的平衡转化率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com