
����Ŀ��CO2��Դ�����õķ���֮һ�Ǻϳɶ����ѣ�CH3OCH3����
��1��CO2 ������ϳɶ����ѵĹ�������Ҫ�������з�Ӧ����ӦI��CO2(g) + H2(g) ![]() CO(g) + H2O(g) H= +41.2 kJmol-1;��ӦII: 2CO2(g) + 6H2(g)
CO(g) + H2O(g) H= +41.2 kJmol-1;��ӦII: 2CO2(g) + 6H2(g) ![]() CH3OCH3(g) + 3H2O(g) H = - 122.5 kJmol-1;���У���ӦII �����¢٢�������ɣ���д����Ӧ�ٵ��Ȼ�ѧ����ʽ��
CH3OCH3(g) + 3H2O(g) H = - 122.5 kJmol-1;���У���ӦII �����¢٢�������ɣ���д����Ӧ�ٵ��Ȼ�ѧ����ʽ��
�� _____
��2 CH3OH(g) ![]() CH3OCH3(g) + H2O(g) H = -23.5 kJmol-1
CH3OCH3(g) + H2O(g) H = -23.5 kJmol-1
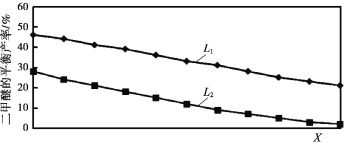
��2��L��L1��L2����X�ֱ����ѹǿ���¶ȣ���ͼ��ʾLһ��ʱ����ӦII�ж����ѵ�ƽ�������X�仯�Ĺ�ϵ������X��������������_____���ж�L1��L2�Ĵ�С�����������ɣ�_____��
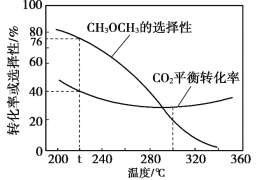
��3����ѹʱ����CO2��H2��ʼ��һ���������£�CO2ƽ��ת���ʺ�ƽ��ʱCH3OCH3��ѡ����![]() �����¶ȱ仯��ͼ��
�����¶ȱ仯��ͼ��
��t �� ʱ����ʼͶ��a molCO2��b mol H2���ﵽƽ��ʱ��ӦII���ĵ�H2�����ʵ���Ϊ______mol��
���¶ȸ���300����CO2ƽ��ת�������¶����߶������ԭ����______��
���𰸡�CO2(g) + 3H2 (g) ![]() CH3OH(g) + H2O(g) H = - 49.5 kJmol-1 �¶� L1>L2����ӦII�����廯ѧ���������ٵķ�Ӧ�����¶�һ��ʱ������ѹǿ��ƽ�������ƶ���������ƽ�����������ͼ1�仯������ͬ 3a��40%��76% ��ӦI��H��0����ӦII��H��0 ���¶�����ʹCO2ת��ΪCO��ƽ��ת����������ʹCO2ת��ΪCH3OCH3��ƽ��ת�����½������������ȳ����½�����
CH3OH(g) + H2O(g) H = - 49.5 kJmol-1 �¶� L1>L2����ӦII�����廯ѧ���������ٵķ�Ӧ�����¶�һ��ʱ������ѹǿ��ƽ�������ƶ���������ƽ�����������ͼ1�仯������ͬ 3a��40%��76% ��ӦI��H��0����ӦII��H��0 ���¶�����ʹCO2ת��ΪCO��ƽ��ת����������ʹCO2ת��ΪCH3OCH3��ƽ��ת�����½������������ȳ����½�����
��������
(1)��ӦII����Ӧ�ڵ÷�Ӧ�٣�
��2������ͼʾ��X�������ѵIJ��ʼ�С��˵��ƽ�������ƶ���
��3����t �� ʱ��CO2ƽ��ת����Ϊ40%��CH3OCH3��ѡ����λ76%��
���¶����ߣ�CO2(g) + H2(g) ![]() CO(g) + H2O(g)ƽ�������ƶ���2CO2(g) + 6H2(g)
CO(g) + H2O(g)ƽ�������ƶ���2CO2(g) + 6H2(g) ![]() CH3OCH3(g) + 3H2O(g)ƽ�������ƶ���
CH3OCH3(g) + 3H2O(g)ƽ�������ƶ���
(1)��ӦII����Ӧ�ڵ÷�Ӧ�٣����ݸ�˹����II��![]() ���ڡ�
���ڡ�![]() ��CO2(g) + 3H2 (g)
��CO2(g) + 3H2 (g) ![]() CH3OH(g) + H2O(g) H =(- 122.5 kJmol-1+23.5 kJmol-1)��2= - 49.5 kJmol-1��
CH3OH(g) + H2O(g) H =(- 122.5 kJmol-1+23.5 kJmol-1)��2= - 49.5 kJmol-1��
��2������ѹǿ��2CO2(g) + 6H2(g) ![]() CH3OCH3(g) + 3H2O(g)�����ƶ��������¶ȣ�2CO2(g) + 6H2(g)
CH3OCH3(g) + 3H2O(g)�����ƶ��������¶ȣ�2CO2(g) + 6H2(g) ![]() CH3OCH3(g) + 3H2O(g)�����ƶ�������ͼʾ��X�������ѵIJ��ʼ�С��˵��ƽ�������ƶ�������X��ʾ�¶ȣ���ӦII�����廯ѧ���������ٵķ�Ӧ�����¶�һ��ʱ������ѹǿ��ƽ�������ƶ���������ƽ�������������L1��L2��
CH3OCH3(g) + 3H2O(g)�����ƶ�������ͼʾ��X�������ѵIJ��ʼ�С��˵��ƽ�������ƶ�������X��ʾ�¶ȣ���ӦII�����廯ѧ���������ٵķ�Ӧ�����¶�һ��ʱ������ѹǿ��ƽ�������ƶ���������ƽ�������������L1��L2��
��3��t �� ʱ��CO2ƽ��ת����Ϊ40%��CH3OCH3��ѡ����λ76%����ʼͶ��a mol CO2������CO2�����ʵ�����a��40%��76%�����ݷ���ʽ������������CO2��3�����������������ʵ�����3a��40%��76%��
�ڷ�ӦI��H��0����ӦII��H��0 ���¶�����ʹCO2ת��ΪCO��ƽ��ת����������ʹCO2ת��ΪCH3OCH3��ƽ��ת�����½������������ȳ����½����ȣ������¶ȸ���300�棬CO2ƽ��ת�������¶����߶�����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴ӦA(g)+ 4B(g)![]() C(g)+ D(g)�������ֲ�ͬ����µķ�Ӧ�������£����з�Ӧ���е�������(����)
C(g)+ D(g)�������ֲ�ͬ����µķ�Ӧ�������£����з�Ӧ���е�������(����)
A. vA=0.15mol/(L��min) B. vB=0.6 mol/(L��min)
C. vC=0.4 mol/(L��min) D. vD=0.01 mol/(L��s)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA��ʾ������������ֵ������˵����ȷ����(����)
A. ��״����11.2 L ND3����������������Ϊ5NA
B. ���2 mol��L��1��NaCl��Һת�Ƶĵ�����Ϊ2NA
C. 100 mL��Al3��Ϊ0.4NA��Al2(SO4)3��Һ�����ʵ���Ũ��Ϊ2.0 mol��L��1
D. ���³�ѹ�£�7.8 g�������к��е�̼̼˫����ĿΪ0.3NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪һ��������п����ϡ���ᷴӦ������H2��Ũ���뷴Ӧʱ��Ĺ�ϵ��ͼ��ʾ�����н��۲���ȷ����
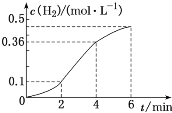
A.����п����Ϊп�ۣ��ɼӿ����H2�ķ�Ӧ����
B.��Ӧǰ4min���¶ȶԷ�Ӧ���ʵ�Ӱ���Ũ�ȴ�
C.��Ӧ��ʼ2min��ƽ����Ӧ�������
D.��Ӧǰ4min������H2��ƽ������v(H2)��0.09mol��L��1��min��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() Ϊ�����ӵ�������ֵ������˵����ȷ����
Ϊ�����ӵ�������ֵ������˵����ȷ����
A. 0.1 mol ��![]() ������
������![]() ������
������
B. pH=1��H3PO4��Һ�У�����![]() ��
��![]()
C. 2.24L����״��������O2����ȫȼ�գ��õ�![]() ��CO2����
��CO2����
D. �ܱ�������1 mol PCl3��1 mol Cl2��Ӧ�Ʊ� PCl5��g��������![]() ��P-Cl��
��P-Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ָ����Ӧ�����ӷ���ʽ��ȷ����(����)
A. ��ϡHNO3�еμ�NaHSO3��Һ��H����HSO![]() ===SO2����H2O
===SO2����H2O
B. ��������Һ�м��������ˮ��Al3����3OH��===Al(OH)3��
C. ����2 mol FeI2����Һ��ͨ��2.5 mol Cl2��8I����2Fe2����5Cl2===10Cl����4I2��2Fe3��
D. �����Ը�����ر���Һ�ζ����2MnO![]() ��16H����5C2O
��16H����5C2O![]() ===2Mn2����10CO2����8H2O
===2Mn2����10CO2����8H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ȣ�ClO2����һ�����������������������ƣ�NaClO3��Ϊԭ���Ʊ���
��1����Ĥ��ⷨ�Ʊ�ClO2��װ��ʾ��ͼ���£�

��֪��ClO2��������Һ�бȽ��ȶ����ڼ�����Һ�в����ȶ����ڡ�
�ٲ���O2�ĵ缫��Ӧʽ��________��
�ڽ�Ϸ�Ӧ����ʽ������ClO2�IJ������̣�_________��
��2���������ԭ���Ʊ�ClO2��![]() �о�����Cl-��������Ӧ��Ӱ�죬ʵ���¼���£�
�о�����Cl-��������Ӧ��Ӱ�죬ʵ���¼���£�
����NaCl ��Ũ��/(g��L1) | ClO2����������/(g��L-1��min-1) | ��ͬʱ�� | |||
10 min | 30 min | 60 min | ClO2 ����/% | Cl2 ���� | |
0 | 0.0035 | 0.0124 | 0.0159 | 97.12 | ���� |
1.00 | 0.0138 | 0.0162 | 0.0163 | 98.79 | ���� |
��NaCl����Ҫ������_______��
��������Ӧ���ܵĹ������£�
��Ӧi��![]() +
+ ![]() + +
+ +
��Ӧii�� Cl2 + H2O2 = 2Cl- + O2�� + 2H+
����Ӧi��д����_________��
�۽�һ���о����֣�δ����Cl-ʱ����ϵ�����Ȼᷢ����Ӧ����Cl-����ӦΪ��ClO3- + 3H2O2 = Cl- + 3O2��+3H2O����Ӧiii����������Ӧi��ii��iii�����ʴ�С��ϵ����Ҫ˵�����ɣ�_________��
��3�����ҹ涨������ˮ��ClO2�IJ��������ø���0.8 mg��L-1����ⲽ�����£�
����ȡ1.0L������ˮ������������ĵ⻯�أ���������������Һ�������ԣ�ʹClO2ת��Ϊ![]() �����������Һ����Һ������
�����������Һ����Һ������
������0.0010 mol/LNa2S2O3��Һ�ζ�����I�в�����I2����֪������II�з�����Ӧ�����ӷ���ʽ��![]()
�ٲ���I�з�����������ԭ��Ӧ�����ӷ���ʽ��________��
�ڵ�����II�г���________��������ʱ��ֹͣ�μ�Na2S2O3��Һ����¼�����Ϊ10.00 mL��
������ˮ����ClO2�IJ���Ũ����______mg��L-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʵ�����Ʊ������������������ʵ���װ�ã��гּ������������ԣ���
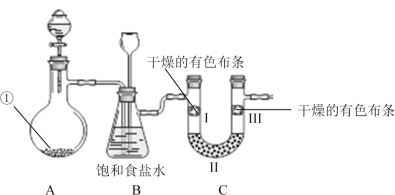
�ش��������⣺
(1)��������ʢ�еĹ���ҩƷ��___��
(2)װ��B�б���ʳ��ˮ�������dz�ȥCl2�е�HCl���壬ͬʱװ��B���ɼ��ʵ�����ʱC���Ƿ�������������������ʱB�е�����Ϊ___��
(3)װ��C��Ŀ������֤�����Ƿ����Ư���ԣ�II���Լ���������___���Ա�I��III�е�����ɵó��Ľ�����___��
(4)��ʵ����Ƶ�ȱ����___���Ľ��ķ�����___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������н��з�ӦCH4(g)+H2O(g) ![]() CO(g)+3H2(g)�� ��H>0�����c(CH4)�淴Ӧʱ��(t)�ı仯��ͼ��ʾ�������ж���ȷ���ǣ� ��
CO(g)+3H2(g)�� ��H>0�����c(CH4)�淴Ӧʱ��(t)�ı仯��ͼ��ʾ�������ж���ȷ���ǣ� ��
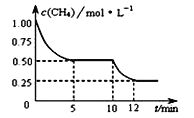
A. 10 minʱ���ı��������������������¶�
B. ��Ӧ���е�12minʱ��CH4��ת����Ϊ25%
C. 0��5 min�ڣ�v(H2)��0.1 mol��(L��min)-1
D. �����£���С���������ƽ���H2Ũ�ȼ�С
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com