
����Ŀ�����ܱ������н��з�ӦCH4(g)+H2O(g) ![]() CO(g)+3H2(g)�� ��H>0�����c(CH4)�淴Ӧʱ��(t)�ı仯��ͼ��ʾ�������ж���ȷ���ǣ� ��
CO(g)+3H2(g)�� ��H>0�����c(CH4)�淴Ӧʱ��(t)�ı仯��ͼ��ʾ�������ж���ȷ���ǣ� ��
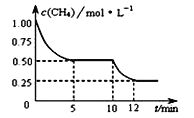
A. 10 minʱ���ı��������������������¶�
B. ��Ӧ���е�12minʱ��CH4��ת����Ϊ25%
C. 0��5 min�ڣ�v(H2)��0.1 mol��(L��min)-1
D. �����£���С���������ƽ���H2Ũ�ȼ�С
���𰸡�A
��������
A. ��ͼ��֪��10min ʱ�����Ũ�ȼ�����С���÷�Ӧ������Ӧ�����ƶ����÷�Ӧ����Ӧ�����ȷ�Ӧ�������������¶ȣ���A��ȷ��
B. ��Ӧ���е�12minʱ��CH4��ת����Ϊ![]() ��100��=75������B����
��100��=75������B����
C. ����ͼ��֪��ǰ5min�ڼ����Ũ����1.00mol/ L��СΪ0.50mol/L����v(CH4) =(1-0.5)molL-1/5min=0.1mol/ (Lmin) ���ɻ�ѧ������֮�ȵ��ڷ�Ӧ����֮�ȣ���v (H2)=3��0.1mol/ (Lmin) =0. 3mol/(Lmin) ����C����
D. �����£���С���������������Ũ��������Ȼѹǿ����ƽ�����淴Ӧ�����ƶ����ƶ��Ľ����С����Ũ�ȵ�����������������ԭ������������Ũ������ƽ���c (H2)����D����
��ѡA��


 ��ѧ��ʦ����ϵ�д�
��ѧ��ʦ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO2��Դ�����õķ���֮һ�Ǻϳɶ����ѣ�CH3OCH3����
��1��CO2 ������ϳɶ����ѵĹ�������Ҫ�������з�Ӧ����ӦI��CO2(g) + H2(g) ![]() CO(g) + H2O(g) H= +41.2 kJmol-1;��ӦII: 2CO2(g) + 6H2(g)
CO(g) + H2O(g) H= +41.2 kJmol-1;��ӦII: 2CO2(g) + 6H2(g) ![]() CH3OCH3(g) + 3H2O(g) H = - 122.5 kJmol-1;���У���ӦII �����¢٢�������ɣ���д����Ӧ�ٵ��Ȼ�ѧ����ʽ��
CH3OCH3(g) + 3H2O(g) H = - 122.5 kJmol-1;���У���ӦII �����¢٢�������ɣ���д����Ӧ�ٵ��Ȼ�ѧ����ʽ��
�� _____
��2 CH3OH(g) ![]() CH3OCH3(g) + H2O(g) H = -23.5 kJmol-1
CH3OCH3(g) + H2O(g) H = -23.5 kJmol-1
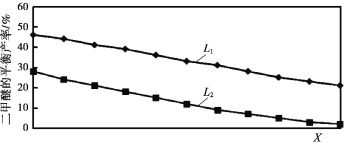
��2��L��L1��L2����X�ֱ����ѹǿ���¶ȣ���ͼ��ʾLһ��ʱ����ӦII�ж����ѵ�ƽ�������X�仯�Ĺ�ϵ������X��������������_____���ж�L1��L2�Ĵ�С�����������ɣ�_____��
��3����ѹʱ����CO2��H2��ʼ��һ���������£�CO2ƽ��ת���ʺ�ƽ��ʱCH3OCH3��ѡ����![]() �����¶ȱ仯��ͼ��
�����¶ȱ仯��ͼ��
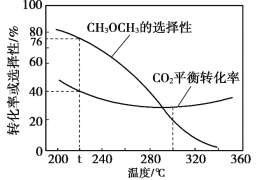
��t �� ʱ����ʼͶ��a molCO2��b mol H2���ﵽƽ��ʱ��ӦII���ĵ�H2�����ʵ���Ϊ______mol��
���¶ȸ���300����CO2ƽ��ת�������¶����߶������ԭ����______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ�Dz��ֶ�����Ԫ��ԭ�Ӱ뾶��ԭ�������Ĺ�ϵ��������˵����ȷ���ǣ� ��
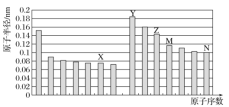
A.Z��N����Ԫ���γɵĻ����������ӻ�����
B.ͨ��M��N�����������ǿ�������ԱȽ����ߵķǽ�����
C.Z���������ֱܷ��ܽ���Y�����������N���⻯���ˮ��Һ��
D.��X��M����Ԫ����ɵĻ���������ˮ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б����еĸ����������������ͼ�����߱�ʾ���� �� ��
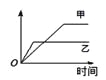
������ Ӧ | ������ | �� | �� | |
A | ��ͬ�����İ�����ͬһ������ | ������ת���� | 500�� | 400�� |
B | �������ء��Ʒֱ�������ˮ��Ӧ | H2���� | �� | �� |
C | ������ɱ�ĺ�ѹ�����У������1�U3��N2��H2�� | ������Ũ�� | ���ԸߵĴ��� | ����һ��Ĵ��� |
D | 2 molSO2��1 molO2������ͬ�¶���2SO2+ O2 | SO3���ʵ��� | 2������ѹ | 10������ѹ |
A. AB. BC. CD. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ͼ��˵����ȷ����
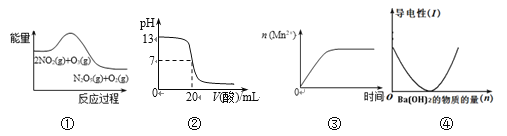
A. �ٱ�ʾ��ѧ��Ӧ2NO2(g) + O3(g) = N2O5(g) + O2(g) ��H > 0
B. �ڱ�ʾ25��ʱ����0.1 mol/L CH3COOH��Һ�ζ�20 mL 0.1 mol/L NaOH��Һ����Һ��pH�����������ı仯
C. �۱�ʾ10 mL 0.01 mol/L����KMnO4��Һ�������0.1 mol/L H2C2O4��Һ���ʱ�� n (Mn2+) ��ʱ��ı仯
D. �ܿɱ�ʾ��ϡ������Һ�еμ�����������Һ����Һ�������������������ʵ����ı仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ�������Ա�������CO2��CH4ת��Ϊ�߸���ֵ��ƷCH3COOH�Ĵ���Ӧ���̡�������ʾ��ͼ���¡�

����˵������ȷ����
A. ����CH3COOH�ܷ�Ӧ��ԭ��������Ϊ100%
B. CH4��CH3COOH����������C�DH����������
C. �١����ų��������γ���C�DC��
D. �ô�������Ч��߷�Ӧ���ƽ��ת����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�ˮ��Һ�д��ڵ���ƽ�⡣
��1�������dz��������ᡣ
�ٴ�����ˮ��Һ�еĵ��뷽��ʽΪ____________��
�����з����У�����ʹ������Һ��CH3COOH����̶��������_______������ĸ��ţ���
a �μ�����Ũ���� b ����Һ
c ��ˮϡ�� d �������������ƾ���
��2����0.1 mol��L-1 NaOH��Һ�ֱ�ζ������Ϊ20mL��Ũ�Ⱦ�Ϊ0.1 mol��L-1������ʹ�����Һ���õ��ζ���������ҺpH�����NaOH��Һ������仯�������ζ����ߡ�
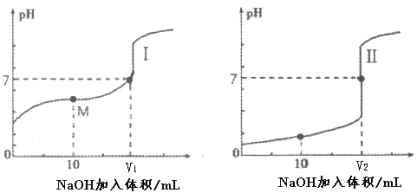
�ٵζ������������___________������I��������������
�ڵζ���ʼǰ��0.1 mol��L-1 NaOH��0.1 mol��L-1�������0.1 mol��L-1����������Һ����ˮ�������c(H+)������_______��Һ��
��ͼI�У�V=10ʱ����Һ�е�c(H+)_________c(OH-) ������>��������������<������ͬ����c(Na+)_________c(CH3COO-)��
��3���±�Ϊijͬѧ����25��ʱ���ס���������Һ��pH��
�� | �� | |
pH | 11 | 11 |
��Һ | ��ˮ | ����������Һ |
�ټ���Һ�е�c(OH-) =___________mol/L��
��25��ʱ��������ļס�������Һ���Ũ�ȵ����ᷴӦ�����ĵ������������_____�ҡ�
�ۼס�����Һ����ˮϡ��10����������Һ��pH����_____�ҡ�
��4��ú̿��ҵ�о������������SO2��Ϊ��ֹ��Ⱦ���������������շ����д������������ʿ���������SO2����____________��
A H2O2 B Na2CO3 C Na2SO3 D Ca(OH)2
��5���±��Ǽ��ֳ�������ĵ��볣��
��ѧʽ | CH3COOH | H2SO3 | HClO | H2CO3 |
���� ���� | 1.8��10-5 | K1=1.23��10-2 K2=6.6��10-8 | 3.0��10-8 | K1=4.4��10-7 K2=4.7��10-11 |
/span>
���·�Ӧ��Ӧ�����ӷ���ʽ��ȷ����___________��
A Na2CO3��Һ��������SO2��CO32-+SO2+H2O = SO32-+HCO3-
B Ư��Һ��Ч��ԭ����ClO-+CO2+H2O = HClO+HCO3-
C ����������Һ��������SO2��ClO-+SO2+H2O = HClO+SO32-
D �����ˮ���е�CaCO3��2CH3COOH+CaCO3 = Ca2++2CH3COO-+H2O+CO2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��W��M��X��Y��Z�����ڱ�ǰ36��Ԫ���е����ֳ���Ԫ�أ���ԭ��������������W��һ�ֺ����ڿ���ʱ����������һЩ����������M���������ǵ����������Ҫ����֮һ��X��ijһ�ֵ����ڸ߿մ������б�����������̫�����������ߵ�ǿ����Ϯ��Y�Ļ�̬ԭ�Ӻ�����6��ԭ�ӹ�����ڰ����״̬��Z���γɺ�ɫ��Z2O�ͺ�ɫ��ZO���������
(1)Y3����̬�����Ų�ʽ�ɱ�ʾΪ________��
(2)MX![]() �Ŀռ乹����________(����������)��
�Ŀռ乹����________(����������)��
(3)M���γɶ����⻯�����MH3�ļ���ǿ��M2H4��ԭ����_________________________________��
(4)���ݵȵ���ԭ����WX���ӵĽṹʽΪ________��
(5)1 mol WX2�к��еĦҼ���ĿΪ________��
(6)H2X������Xԭ�ӹ�����ӻ�����Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л���Ӧ�У�������ȡ����Ӧ���ǣ� ��
A. ![]() +Cl2
+Cl2![]() +HCl
+HCl
B. CH2=CH2 + Br2 ��CH2BrCH2Br
C. ClCH2CH2CH3+NaOH![]() HOCH2CH2CH3+NaCl
HOCH2CH2CH3+NaCl
D. ![]() +HO-NO2
+HO-NO2![]() +H2O
+H2O
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com