
【题目】可逆反应A(g)+ 4B(g)![]() C(g)+ D(g),在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
C(g)+ D(g),在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
A. vA=0.15mol/(L·min) B. vB=0.6 mol/(L·min)
C. vC=0.4 mol/(L·min) D. vD=0.01 mol/(L·s)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】砷为第四周期第ⅤA族元素,依据它在周期表中的位置,推测砷不可能具有的性质是
A.砷在通常状况下为固体
B.砷的最高正化合价为+5
C.砷的最高价氧化物的水化物砷(H3AsO4)的酸性比磷酸(H3PO4)强
D.砷化氢(AsH3)不如氨气(NH3)稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加0.1 mol MnO2粉末于50 mL过氧化氢溶液(H2O2 , ρ=1.1 g·mL-1)中,在标准状况下放出气体的体积和时间的关系如图所示。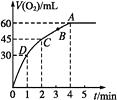
(1)实验时放出气体的总体积是。
(2)放出一半气体所需时间为。
(3)A、B、C、D各点反应速率由快到慢的顺序为。
(4)解释反应速率变化的原因。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向100mL0.1mol/LNH4HSO4溶液中滴加0.1mol/L的NaOH溶液,所得溶液PH与NaOH溶液体积的关系曲线如图所示,下列说法正确的是

A. a、b、c、d四个点中,水的电离程度最大的是d
B. a点溶液中:c(NH3·H2O)+c(H+)=c(OH—)
C. b点溶液中:c(Na+)+c(NH4+)=c(SO42—)
D. c点溶液中:4c(Na+)= 3[c(SO42—) +c(NH4+)+ c(NH3·H2O)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Hg是水体污染的重金属元素之一。水溶液中二价汞的主要存在形态与C1-、OH-的浓度关系如图所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-lgc(Cl-)]。下列说法不正确的是
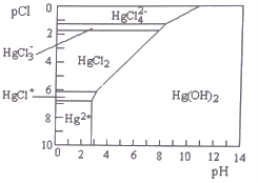
A. 可用如下方法除去污水中的Hg2+: FeS(s)+ Hg2+(aq)=HgS(s)+Fe2+(aq)
B. 当溶液pCl保持在1,pH在6~8时,汞元素主要以HgCl42-形式存在
C. HgCl2是一种强电解质,其电离方程式是:HgCl2=HgCl++Cl-
D. 当溶液pH保持在5,pCl由2改变至6时.可使HgCl2转化为Hg(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解尿素的碱性溶掖可以制取氢气,其装置如图所示(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极).下列有关说法中不正确的是( ) 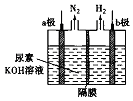
A.电解过穆中b极附近溶液碱性明显增强
B.溶液中的OH﹣逐渐向a极区附近移动
C.若在b极产生标准状况下224mL氢气,则消耗尿素2g
D.a极反应式为CO(NH2)2+8OH﹣﹣6e﹣═CO32﹣+N2↑+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如下图所示,其中阴极和阳极均为惰性气体电极。测得同温同压下,气体甲与气体乙的体积比约为1:2,以下说法正确的是

A. a极与电源的负极相连
B. 产物丁为硫酸溶液
C. 离子交换膜d为阴离子交换膜(允许阴离子通过)
D. b电极反立式为2H2O+2e-=2OH-+H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com