
【题目】Hg是水体污染的重金属元素之一。水溶液中二价汞的主要存在形态与C1-、OH-的浓度关系如图所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-lgc(Cl-)]。下列说法不正确的是
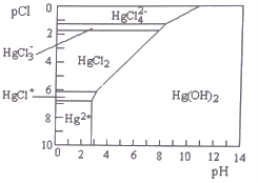
A. 可用如下方法除去污水中的Hg2+: FeS(s)+ Hg2+(aq)=HgS(s)+Fe2+(aq)
B. 当溶液pCl保持在1,pH在6~8时,汞元素主要以HgCl42-形式存在
C. HgCl2是一种强电解质,其电离方程式是:HgCl2=HgCl++Cl-
D. 当溶液pH保持在5,pCl由2改变至6时.可使HgCl2转化为Hg(OH)2
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某温度下反应:ClF(g)+F2(g) ![]() ClF3(g)△H<0,在密闭容器中达到平衡,下列说法中正确的是( )
ClF3(g)△H<0,在密闭容器中达到平衡,下列说法中正确的是( )
A.温度不变,缩小体积,ClF的转化率增大
B.温度不变,增大体积,ClF3的产率提高
C.升高温度,增大体积,有利于平衡向正向移动
D.降低温度,体积不变,F2的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ:Zn—MnO2干电池应用广泛,其电解质溶液是ZnCl2—NH4Cl混合溶液。
(1)该电池的负极材料是________。电池工作时,电子流向________(填“正极”或“负极”)。
(2)ZnCl2—NH4Cl混合溶液中含有杂质Cu2+,会加速其电极的腐蚀,其主要原因是_________________________________________。欲除去Cu2+,最好选用下列试剂中的________(填选项)。
A.NaOH B.Zn C.Fe D.NH3·H2O
(3)此废旧电池的处理方法是回收,目的是为了_________________________。
(4)若有6.5g锌溶解,则流过外电路的电子的物质的量是___________ mol。
Ⅱ:向FeI2溶液中不断通入Cl2,溶液中I-、I2、IO3-、Fe2+、Fe3+等粒子的物质的量随n(Cl2):n(FeI2)的变化可用下图简单表示:
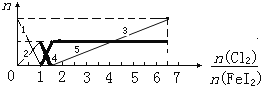
(1)粗线5、细线3分别代表哪种粒子的物质的量随n(Cl2):n(FeI2)变化的情况(填写
粒子化学式)___________、________________。
(2)当n(Cl2):n(FeI2)=6时,溶液中n(Cl-):n(IO3-)=_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A(g)+ 4B(g)![]() C(g)+ D(g),在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
C(g)+ D(g),在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
A. vA=0.15mol/(L·min) B. vB=0.6 mol/(L·min)
C. vC=0.4 mol/(L·min) D. vD=0.01 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素原子半径与原子序数的关系图,下列说法正确的是( )

A. M的最高价氧化物对应水化物能分别与Z、R的最高价氧化物对应水化物反应
B. Y的单质能从含R简单离子的水溶液人中置换出R单质
C. X、N两种元素组成的化合物熔点很低
D. 简单离子的半径:Z<X< Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请按要求回答问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | ④ | ⑤ | |||
3 | ⑥ | ⑦ | ⑧ | ⑨ |
(1)表中元素______的非金属性最强,元素_____的金属性最强(填元素符号)。
(2)表中元素③的原子结构示意图______;元素⑨形成的氢化物的电子式___________。
(3)表中元素④、⑨形成的氢化物的稳定性顺序为_____> (填化学式)。
(4)表中元素⑧和⑨的最高价氧化物对应水化物的酸性强弱为_____> (填化学式)。
(5)表中元素③、④、⑥、⑦的原子半径大小为____> > > (填元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性锌锰电池是日常生活中消耗量最大的电池,其构造如图所示。
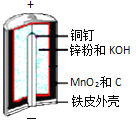
放电时总反应为:Zn + 2H2O + 2MnO2![]() Zn(OH)2 + 2MnOOH
Zn(OH)2 + 2MnOOH
从废旧碱性锌锰电池中回收Zn和MnO2的工艺如下:
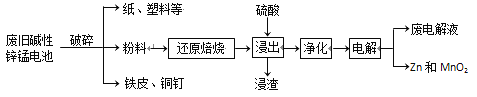
回答下列问题:
(1)MnOOH中,Mn元素的化合价为________。
(2)“还原焙烧”过程中,高价金属化合物被还原为低价氧化物或金属单质(其中MnOOH、MnO2被还原成MnO),主要原因是“粉料”中含有________。
(3)“净化”是为了除去浸出液中的Fe2+,方法是:加入________(填化学式)溶液将Fe2+氧化为Fe3+,再调节pH使Fe3+完全沉淀。(离子浓度小于1×10-5mol·L-1即为沉淀完全)已知浸出液中Mn2+、Zn2+的浓度约为0.1 mol·L-1,根据下列数据计算调节pH的合
理范围是________至________。
化合物 | Mn(OH)2 | Zn(OH)2 | Fe(OH)3 |
KSP近似值 | 10-13 | 10-17 | 10-38 |
(4)“电解”时,阳极的电极反应式为_____。本工艺中应循环利用的物质是_____(填化学式)。
(5)若将“粉料”直接与盐酸共热反应后过滤,滤液的主要成分是ZnCl2和MnCl2。“粉料”中的MnOOH与盐酸反应的化学方程式为________。
(6)某碱性锌锰电池维持电流强度0.5A(相当于每秒通过5×10-6 mol电子),连续工作80分钟即接近失效。如果制造一节电池所需的锌粉为6 g,则电池失效时仍有________%的金属锌未参加反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期非金属元素甲~戊在元素周期表中的相对位置如下表所示:
甲 | 乙 | |
丙 | 丁 | 戊 |
下列判断正确的是( )
A.原子半径:丙<丁<戊
B.非金属性:甲>丙
C.氧化物的水化物:丙<丁<戊
D.最外层电子数:甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的除杂,下列说法正确的是( )
A.除去KNO3溶液中的少量KCl,加过量AgNO3溶液并过滤
B.除去CO气体中混有的少量CO2,可通过足量的灼热的CuO
C.通过蒸馏除去自来水中混有的各种盐以获得蒸馏水
D.通过分液除去酒精中混有的水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com