
【题目】Ⅰ:Zn—MnO2干电池应用广泛,其电解质溶液是ZnCl2—NH4Cl混合溶液。
(1)该电池的负极材料是________。电池工作时,电子流向________(填“正极”或“负极”)。
(2)ZnCl2—NH4Cl混合溶液中含有杂质Cu2+,会加速其电极的腐蚀,其主要原因是_________________________________________。欲除去Cu2+,最好选用下列试剂中的________(填选项)。
A.NaOH B.Zn C.Fe D.NH3·H2O
(3)此废旧电池的处理方法是回收,目的是为了_________________________。
(4)若有6.5g锌溶解,则流过外电路的电子的物质的量是___________ mol。
Ⅱ:向FeI2溶液中不断通入Cl2,溶液中I-、I2、IO3-、Fe2+、Fe3+等粒子的物质的量随n(Cl2):n(FeI2)的变化可用下图简单表示:
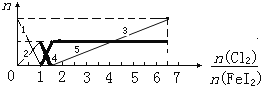
(1)粗线5、细线3分别代表哪种粒子的物质的量随n(Cl2):n(FeI2)变化的情况(填写
粒子化学式)___________、________________。
(2)当n(Cl2):n(FeI2)=6时,溶液中n(Cl-):n(IO3-)=_________________
【答案】Zn(或锌) 正极锌与还原出的铜构成铜锌原电池而加快锌的腐蚀B防止电解液污染土壤和金属材料的浪费0.2molFe3+IO3-20:3
【解析】
根据原电池的工作原理,根据除杂的基本要求,结合环保思想可解答第Ⅰ问;根据常见粒子的氧化性、还原性的强弱去思考反应的顺序,利用已知信息结合图象,确定溶液中存在的粒子种类,由电子转移守恒可得出正确答案。
Ⅰ:(1)根据原电池的工作原理,较活泼金属作负极,所以Zn—MnO2干电池的负极材料是Zn(或锌);电池工作时,电子从负极流出,经导线流向正极;(2)锌比铜活泼,锌与置换出来的铜构成原电池,锌作负极,因此加快了锌的腐蚀;欲除去Cu2+,最好选用金属锌,防止引入杂质;(3)废旧电池采用回收的处理方法是为了防止电解液污染土壤和地下水源,同时可回收金属材料;(4)若有6.5g锌溶解,即0.1mol锌,则电路中流过电子的物质的量为0.2mol。较理池的构成条件和
Ⅱ:已知微粒的还原性强弱为I->Fe2+,当n(Cl2):n(FeI2)=1时,发生的反应为Cl2+2I-=2 Cl-+I2,当n(Cl2):n(FeI2)=1.5时,发生的反应为3Cl2+2Fe2++4I-=2Fe3++6Cl-+2I2。(1)对照图象分析可知粗线5代表Fe3+的物质的量变化情况,由于Cl2的氧化性强,当溶液中没有I-时,Cl2把I2氧化为IO3-等,而细线3是在n(Cl2):n(FeI2)>1.5时才生成的,因此代表的是IO3-物质的量变化情况;(2)当n(Cl2):n(FeI2)=6时,由图象可知,溶液中含有的粒子是Cl-、Fe3+、I2和IO3-,设n(Cl2)=6amol,则n(FeI2)=amol,设生成的n(IO3-)=xmol,则生成的n(I2)=(2a-x)/2mol,由电子转移守恒可知,Cl2在反应中生成Cl-,得到的电子为12amol,Fe2+转变为Fe3+,失去的电子为amol,生成IO3-失去的电子为6xmol,生成I2失去的电子为(2a-x)mol,则有12amol=amol+6xmol+(2a-x)mol,x=1.8amol,所以n(Cl-):n(IO3-)=12a/1.8a=20:3。


科目:高中化学 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理解释的是( )
A.在溴水中存在如下平衡:Br2+H2O ![]() HBr+HBrO,当加入NaOH溶液后颜色变浅
HBr+HBrO,当加入NaOH溶液后颜色变浅
B.对2H2O2![]() 2H2O+O2的反应,使用MnO2可加快制O2的反应速率
2H2O+O2的反应,使用MnO2可加快制O2的反应速率
C.反应CO+NO2![]() CO2+NO ΔH<0,升高温度使平衡向逆反应方向移动
CO2+NO ΔH<0,升高温度使平衡向逆反应方向移动
D.合成氨反应:N2+3H2![]() 2NH3 ΔH<0,为使氨的产率提高,理论上应采取低温高压的措施
2NH3 ΔH<0,为使氨的产率提高,理论上应采取低温高压的措施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】晶体硅是制备太阳能电池板的主要原料,电池板中还含有硼、氮、钛、钻、钙等多种化学物质。
请回答下列问题:
(1)第二周期元素的电负性按由小到大的顺序排列,B元素排在第__________位。
(2)硅酸根有多种结构形式,一种无限长链状结构如图1所示,其化学式为____________,Si原子的杂化类型为__________________。
(3)N元素位于元素周期表_____________区;基态N原子中,核外电子占据最高能级的电子云有____个伸展方向。
(4)[Co(NH3)6]3+的几何构型为正八面体形,Co在中心。
①[Co(NH3)6]3+中,1个Co提供_______________个空轨道。
②若将[Co(NH3)6]3+中的两个NH3分子换成两个Cl-,可以形成_________种不同的结构形式。
(5)—种由Ca、Ti、O三种元素形成的晶体的立方晶胞结构如图2所示。
①与Ti紧邻的Ca有___________________个。
②若Ca与O之间的最短距离为α pm,阿伏加德罗常数的值为NA,则晶体的密度ρ=__________________g· cm-3(用含α、NA的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷为第四周期第ⅤA族元素,依据它在周期表中的位置,推测砷不可能具有的性质是
A.砷在通常状况下为固体
B.砷的最高正化合价为+5
C.砷的最高价氧化物的水化物砷(H3AsO4)的酸性比磷酸(H3PO4)强
D.砷化氢(AsH3)不如氨气(NH3)稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各溶液中,离子一定能大量共存的是( )
A.强碱性溶液中:K+、Al3+、Cl-、SO42-
B.在无色透明的溶液中:K+、Cu2+、SO42-、NO3-
C.含有0.1 mol·L-1 Ca2+的溶液中:Na+、K+、CO32-、Cl-
D.室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加0.1 mol MnO2粉末于50 mL过氧化氢溶液(H2O2 , ρ=1.1 g·mL-1)中,在标准状况下放出气体的体积和时间的关系如图所示。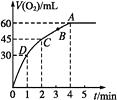
(1)实验时放出气体的总体积是。
(2)放出一半气体所需时间为。
(3)A、B、C、D各点反应速率由快到慢的顺序为。
(4)解释反应速率变化的原因。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Hg是水体污染的重金属元素之一。水溶液中二价汞的主要存在形态与C1-、OH-的浓度关系如图所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-lgc(Cl-)]。下列说法不正确的是
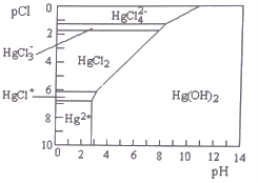
A. 可用如下方法除去污水中的Hg2+: FeS(s)+ Hg2+(aq)=HgS(s)+Fe2+(aq)
B. 当溶液pCl保持在1,pH在6~8时,汞元素主要以HgCl42-形式存在
C. HgCl2是一种强电解质,其电离方程式是:HgCl2=HgCl++Cl-
D. 当溶液pH保持在5,pCl由2改变至6时.可使HgCl2转化为Hg(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、生产密切相关,下列说法错误的是( )
A.以电解饱和食盐水制取氯气等产品的工业称为“氯碱工业”
B.氯气可用来对自来水杀菌消毒
C.碘化银可用于人工降雨
D.为了消除碘缺乏病,在食用盐中加入一定量的碘单质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com