
【题目】下列事实中,不能用勒夏特列原理解释的是( )
A.在溴水中存在如下平衡:Br2+H2O ![]() HBr+HBrO,当加入NaOH溶液后颜色变浅
HBr+HBrO,当加入NaOH溶液后颜色变浅
B.对2H2O2![]() 2H2O+O2的反应,使用MnO2可加快制O2的反应速率
2H2O+O2的反应,使用MnO2可加快制O2的反应速率
C.反应CO+NO2![]() CO2+NO ΔH<0,升高温度使平衡向逆反应方向移动
CO2+NO ΔH<0,升高温度使平衡向逆反应方向移动
D.合成氨反应:N2+3H2![]() 2NH3 ΔH<0,为使氨的产率提高,理论上应采取低温高压的措施
2NH3 ΔH<0,为使氨的产率提高,理论上应采取低温高压的措施
【答案】B
【解析】A项,加入NaOH溶液时,NaOH和HBr、HBrO发生中和反应,从而影响化学平衡,促进溴和水的反应,所以可以用勒夏特里原理解释,A不符合题意;
B项,催化剂同等程度的改变正逆反应速率,对化学平衡状态无影响,所以不能用勒夏特列原理解释,B符合题意;
C项,该反应是放热反应,升高温度,可逆反应向吸热反应方向(逆反应方向)移动,所以可以用勒夏特里原理解释,C不符合题意;
D项,该反应是反应前后气体体积减小的放热反应,降低温度、增大压强有利于平衡向正反应方向移动,从而促进氨气的生成,所以可以用勒夏特里原理解释,D不符合题意。
所以答案是:B
【考点精析】本题主要考查了化学平衡移动原理以及影响因素的相关知识点,需要掌握影响因素:①浓度:增大反应物(或减小生成物)浓度,平衡向正反应方向移动;②压强:增大压强平衡向气体体积减小的方向移动.减小压强平衡向气体体积增大的方向移动;③温度:升高温度,平衡向吸热反应方向移动.降低温度,平衡向放热反应方向移动;④催化剂:不能影响平衡移动才能正确解答此题.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知:有机物A的产量可以用来衡量一个国家的石油化工发展水平。现以A为主要原料合成乙酸乙酯,其合成路线如图所示。

(1)B中的含氧官能团名称为______。
(2)反应①的反应类型是______。
(3)反应②的化学方程式是______。
(4)某学生用图所示的实验装置制取少量乙酸乙酯。实验结束后,试管甲中上层为透明的、不溶于水的油状液体。

①试管甲中的导管不伸入饱和Na2CO3溶液的液面以下的原因是______。
②欲分离出试管甲中的油状液体,必须使用的玻璃仪器是______。
(5)下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有______(填序号)。
a.混合物中各物质的浓度不再变化
b.单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
c.单位时间里,生成1mol乙酸乙酯,同时生成1mol乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于食品添加剂的说法,不正确的是( )
A.醋可同时用作防腐剂和调味剂
B.食品添加剂必须用天然物质制造
C.柠檬黄常用作着色剂,改善食品色泽
D.食品添加剂在合理限量范围内使用是可以的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】刚刚从农业学院毕业的小刘,准备利用所学的知识在农村搞无土栽培。他配制的培养液中含有Mg2+、K+、Ca2+、Zn2+,其浓度都是0.1molL﹣1,培养一段时间后,培养液中剩余最多的是 ( )
A.Ca2+ B.Mg2+ C.Cu2+ D.K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关节炎是因为在关节滑液中形成了尿酸钠晶体,尤其是在寒冷季节易诱发关节疼痛,其化学机理如下:
①HUr+H2O ![]() Ur-+H3O+ ,
Ur-+H3O+ ,
尿酸 尿酸根离子
②Ur-(aq)+Na+(aq) ![]() NaUr(s)。下列对反应②的叙述正确的是( )
NaUr(s)。下列对反应②的叙述正确的是( )
A.正反应为吸热反应
B.正反应为放热反应
C.升高温度,平衡向正反应方向移动
D.降低温度,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对已达到化学平衡的下列反应2X(g)+Y(g) ![]() 2Z(g)减小压强时,对反应产生的影响是( )
2Z(g)减小压强时,对反应产生的影响是( )
A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C.正、逆反应速率都减小,平衡向逆反应方向移动
D.正、逆反应速率都增大,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是
A.同周期元素中,ⅦA族元素的原子半径最大
B.ⅥA族元素的原子,其半径越大,越容易得到电子
C.室温时,0族元素的单质都是气体
D.元素周期表中从ⅢB到ⅡB这8个纵行的元素都是金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下反应:ClF(g)+F2(g) ![]() ClF3(g)△H<0,在密闭容器中达到平衡,下列说法中正确的是( )
ClF3(g)△H<0,在密闭容器中达到平衡,下列说法中正确的是( )
A.温度不变,缩小体积,ClF的转化率增大
B.温度不变,增大体积,ClF3的产率提高
C.升高温度,增大体积,有利于平衡向正向移动
D.降低温度,体积不变,F2的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ:Zn—MnO2干电池应用广泛,其电解质溶液是ZnCl2—NH4Cl混合溶液。
(1)该电池的负极材料是________。电池工作时,电子流向________(填“正极”或“负极”)。
(2)ZnCl2—NH4Cl混合溶液中含有杂质Cu2+,会加速其电极的腐蚀,其主要原因是_________________________________________。欲除去Cu2+,最好选用下列试剂中的________(填选项)。
A.NaOH B.Zn C.Fe D.NH3·H2O
(3)此废旧电池的处理方法是回收,目的是为了_________________________。
(4)若有6.5g锌溶解,则流过外电路的电子的物质的量是___________ mol。
Ⅱ:向FeI2溶液中不断通入Cl2,溶液中I-、I2、IO3-、Fe2+、Fe3+等粒子的物质的量随n(Cl2):n(FeI2)的变化可用下图简单表示:
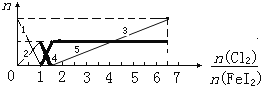
(1)粗线5、细线3分别代表哪种粒子的物质的量随n(Cl2):n(FeI2)变化的情况(填写
粒子化学式)___________、________________。
(2)当n(Cl2):n(FeI2)=6时,溶液中n(Cl-):n(IO3-)=_________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com