
【题目】已知:有机物A的产量可以用来衡量一个国家的石油化工发展水平。现以A为主要原料合成乙酸乙酯,其合成路线如图所示。

(1)B中的含氧官能团名称为______。
(2)反应①的反应类型是______。
(3)反应②的化学方程式是______。
(4)某学生用图所示的实验装置制取少量乙酸乙酯。实验结束后,试管甲中上层为透明的、不溶于水的油状液体。

①试管甲中的导管不伸入饱和Na2CO3溶液的液面以下的原因是______。
②欲分离出试管甲中的油状液体,必须使用的玻璃仪器是______。
(5)下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有______(填序号)。
a.混合物中各物质的浓度不再变化
b.单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
c.单位时间里,生成1mol乙酸乙酯,同时生成1mol乙醇
【答案】 羟基 加成 2CH3CH2OH+O2![]() 2CH3CHO+2H2O 防止溶液倒吸 分液漏斗 a c
2CH3CHO+2H2O 防止溶液倒吸 分液漏斗 a c
【解析】有机物A的产量可以用来衡量一个国家的石油化工发展水平,则A是乙烯,乙烯和水反应生成乙醇,则B是乙醇,乙醇被氧气氧化生成C,C反应生成D,D和乙醇反应生成乙酸乙酯,则D是乙酸,C是乙醛。(1)B是乙醇,则B中的官能团是羟基;(2)反应①是乙烯与水在催化剂作用下发生加成反应生成乙醇,反应类型是加成反应;(3)反应②是在铜作催化剂、加热条件下,乙醇被氧气氧化生成乙醛和水,反应方程式为2CH3CH2OH+O2![]() 2CH3CHO+2H2O;(5)a.混合物中各物质的浓度不再变化,则反应达平衡状态,故正确;b.单位时间里,消耗1mol乙醇,同时消耗1mol乙酸,反应方向相同,所以不能作为判断依据,故错误;c.单位时间里,生成1mol乙酸乙酯,同时生成1mol乙醇,说明正逆反应速率相等,反应达到平衡状态,故正确。答案选a c。
2CH3CHO+2H2O;(5)a.混合物中各物质的浓度不再变化,则反应达平衡状态,故正确;b.单位时间里,消耗1mol乙醇,同时消耗1mol乙酸,反应方向相同,所以不能作为判断依据,故错误;c.单位时间里,生成1mol乙酸乙酯,同时生成1mol乙醇,说明正逆反应速率相等,反应达到平衡状态,故正确。答案选a c。


科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式正确的是
A. 0.01mol/L NH4Al(SO4)2溶液与0.02mol/LBa(OH)2溶液等体积混合产生沉淀:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3H2O
B. 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+=H2SiO3↓+2Na+
C. NH4HCO3溶液与过量NaOH溶液共热:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
D. 浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+ ![]() Fe3++3NO2↑+3H2O
Fe3++3NO2↑+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据人民网报道,有一集团拟将在太空建立巨大的集光装置,把太阳光变成激光用于分解海水制氢,其反应可表示为:2H2O ![]() 2H2↑+O2↑.有下列几种说法:
2H2↑+O2↑.有下列几种说法:
①水分解反应是放热反应;
②氢气是一级能源;
③使用氢气作燃料有助于控制温室效应;
④若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可改善生存条件.
其中叙述正确的是( )
A.①②
B.②③
C.③④
D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,H2(g)+CO2 (g)H2O(g)+CO(g)的平衡常数K= ![]() ,该温度下在甲、乙、丙三个恒容密闭容器中,投入H2 (g)和CO2 (g),其起始浓度如表所示,下列判断不正确的是( )
,该温度下在甲、乙、丙三个恒容密闭容器中,投入H2 (g)和CO2 (g),其起始浓度如表所示,下列判断不正确的是( )
起始浓度 | 甲 | 乙 | 丙 |
c(H2)/molL﹣1 | 0.010 | 0.020 | 0.020 |
c(CO2)/molL﹣1 | 0.010 | 0.010 | 0.020 |
A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.008 molL﹣1
D.反应开始时,乙中的反应速率最快,甲中的反应速率最慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁-空气电池的总反应方程式为:2Mg+O2+2H2O=2Mg(OH)2,其工作原理如图所示,下列说法不正确是( )
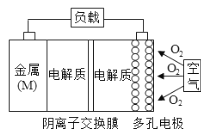
A. 反应过程中化学能转变成电能
B. 该电池的正极反应方程式为O2+4e-+2H2O=4OH-
C. 为防止负极区沉积Mg(OH)2,宜采用中性电解质及阴离子交换膜
D. 采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在合理的膳食中,糖类、脂肪和蛋白质三者供热能由多到少的顺序是( )
A.糖类、蛋白质、脂肪
B.脂肪、糖类、蛋白质
C.蛋白质、脂肪、糖类
D.糖类、脂肪、蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
⑴CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=﹣870.3kJ/mol
⑵C(s)+O2(g)═CO2(g)△H2=﹣393.5kJ/mol
⑶H2(g)+ ![]() O2(g)═H2O(l)△H3=﹣285.8kJ/mol
O2(g)═H2O(l)△H3=﹣285.8kJ/mol
则反应2C(s)+2H2(g)+O2(g)═CH3COOH(l)的焓变为( )
A.﹣488.3 kJ/mol
B.﹣244.15 kJ/mol
C.488.3 kJ/mol
D.244.15 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理解释的是( )
A.在溴水中存在如下平衡:Br2+H2O ![]() HBr+HBrO,当加入NaOH溶液后颜色变浅
HBr+HBrO,当加入NaOH溶液后颜色变浅
B.对2H2O2![]() 2H2O+O2的反应,使用MnO2可加快制O2的反应速率
2H2O+O2的反应,使用MnO2可加快制O2的反应速率
C.反应CO+NO2![]() CO2+NO ΔH<0,升高温度使平衡向逆反应方向移动
CO2+NO ΔH<0,升高温度使平衡向逆反应方向移动
D.合成氨反应:N2+3H2![]() 2NH3 ΔH<0,为使氨的产率提高,理论上应采取低温高压的措施
2NH3 ΔH<0,为使氨的产率提高,理论上应采取低温高压的措施
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com