
【题目】下列物质在水溶液中的电离方程式:
①NaHCO3__________
②NaHSO4_______________
科目:高中化学 来源: 题型:
【题目】我国化学家近年来合成的聚乙炔衍生物分子M的结构式及M在稀硫酸作用下的水解过程如图:下列有关说法中不正确的是( )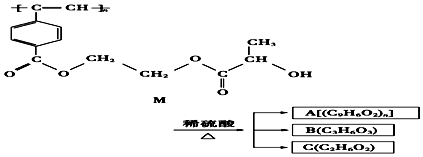
A.M与A均能使酸性高锰酸钾溶液和溴水褪色
B.B中含有羧基和羟基两种官能团,B能发生消去反应和酯化反应
C.1molM与热的烧碱溶液反应,可消耗2nmol的NaOH
D.A,B,C各1mol分别与金属钠反应,放出气体的物质的量之比为1:2:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组对铝热反应实验展开研究。现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2054 | 1535 | 1462 |
沸点/℃ | 2467 | 2980 | 2750 | -- |
Ⅰ.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?答:_____ (填“合理”或“不合理”)
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是_____ ,反应的离子方程式为____ __。
(3)实验室溶解该熔融物,下列试剂中最好的是___ ___(填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4molL-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
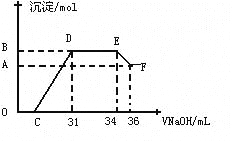
(4)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为____ __
(5)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为____ _ ,上述现象说明溶液中_____ _结合OH—的能力比___ ___强(填离子符号)。
(6)B点对应的沉淀的物质的量为____ __mol,C点对应的氢氧化钠溶液的体积为____ __mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:有机物A的产量可以用来衡量一个国家的石油化工发展水平。现以A为主要原料合成乙酸乙酯,其合成路线如图所示。

(1)B中的含氧官能团名称为______。
(2)反应①的反应类型是______。
(3)反应②的化学方程式是______。
(4)某学生用图所示的实验装置制取少量乙酸乙酯。实验结束后,试管甲中上层为透明的、不溶于水的油状液体。

①试管甲中的导管不伸入饱和Na2CO3溶液的液面以下的原因是______。
②欲分离出试管甲中的油状液体,必须使用的玻璃仪器是______。
(5)下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有______(填序号)。
a.混合物中各物质的浓度不再变化
b.单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
c.单位时间里,生成1mol乙酸乙酯,同时生成1mol乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上一般采用下列两种反应合成甲醇.
反应Ⅰ:CO(g)+2H2(g)CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H2
下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K):
温度 | 250℃ | 300℃ | 350℃ |
K | 2.0 | 0.27 | 0.012 |
(1)在一定条件下将2mol CO和6mol H2充入2L的密闭容器中发生反应Ⅰ,5min后测得c(CO)=0.4mol/L,计算可得此段时间的反应速率(用H2表示)为mol/(Lmin).
(2)由表中数据判断△H10 (填“>”、“<”或“=”);
反应CO2(g)+H2(g)CO(g)+H2O(g)△H3= (用△H1和△H2表示).
(3)若容器容积不变,则下列措施可提高反应Ⅰ中CO转化率的是 (填字母序号).
a.充入CO,使体系总压强增大 b.将CH3OH(g)从体系中分离
c.充入He,使体系总压强增大 d.使用高效催化剂
(4)写出反应Ⅱ的化学平衡常数表达式:KⅡ=;保持恒温恒容,将反应Ⅱ的平衡体系中各物质浓度均增大为原来的2倍,则化学平衡移动(填“正向”、“逆向”或“不”),平衡常数KⅡ(填“变大”、“变小”或“不变”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁片与稀硫酸反应制氢气时,下列措施不能使反应速率加快的是( )
A.加热
B.不用稀硫酸,改用98%的浓硫酸
C.滴加少量CuSO4溶液
D.不用铁片,改用铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于食品添加剂的说法,不正确的是( )
A.醋可同时用作防腐剂和调味剂
B.食品添加剂必须用天然物质制造
C.柠檬黄常用作着色剂,改善食品色泽
D.食品添加剂在合理限量范围内使用是可以的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是
A.同周期元素中,ⅦA族元素的原子半径最大
B.ⅥA族元素的原子,其半径越大,越容易得到电子
C.室温时,0族元素的单质都是气体
D.元素周期表中从ⅢB到ⅡB这8个纵行的元素都是金属元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com