
【题目】甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上一般采用下列两种反应合成甲醇.
反应Ⅰ:CO(g)+2H2(g)CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H2
下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K):
温度 | 250℃ | 300℃ | 350℃ |
K | 2.0 | 0.27 | 0.012 |
(1)在一定条件下将2mol CO和6mol H2充入2L的密闭容器中发生反应Ⅰ,5min后测得c(CO)=0.4mol/L,计算可得此段时间的反应速率(用H2表示)为mol/(Lmin).
(2)由表中数据判断△H10 (填“>”、“<”或“=”);
反应CO2(g)+H2(g)CO(g)+H2O(g)△H3= (用△H1和△H2表示).
(3)若容器容积不变,则下列措施可提高反应Ⅰ中CO转化率的是 (填字母序号).
a.充入CO,使体系总压强增大 b.将CH3OH(g)从体系中分离
c.充入He,使体系总压强增大 d.使用高效催化剂
(4)写出反应Ⅱ的化学平衡常数表达式:KⅡ=;保持恒温恒容,将反应Ⅱ的平衡体系中各物质浓度均增大为原来的2倍,则化学平衡移动(填“正向”、“逆向”或“不”),平衡常数KⅡ(填“变大”、“变小”或“不变”).
【答案】
(1)0.24
(2)<,△H2﹣△H1
(3)b
(4)![]() ,正向,不变
,正向,不变
【解析】解:(1)CO浓度变化量为 ![]() ﹣0.4mol/L=0.6mol/L,故v(CO)=
﹣0.4mol/L=0.6mol/L,故v(CO)= ![]() =0.12mol/(Lmin),速率之比等于化学计量数之比,故v(H2)=2v(CO)=2×0.16mol/(Lmin)=0.24mol/(Lmin),
=0.12mol/(Lmin),速率之比等于化学计量数之比,故v(H2)=2v(CO)=2×0.16mol/(Lmin)=0.24mol/(Lmin),
所以答案是:0.24;
(2)由表中数据可知,随温度升高,平衡常数K减小,说明温度升高,平衡逆向进行,所以正向是放热反应,即△H1<0,
反应Ⅰ:CO(g)+2H2(g)CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H2
根据盖斯定律Ⅱ﹣Ⅰ得到CO2(g)+H2(g)CO(g)+H2O(g)△H3=△H2﹣△H1,
所以答案是:<;△H2﹣△H1;
(3)a.充入CO,使体系总压强增大,平衡向正反应移动,但CO的转化率降低,故a错误;
b.将CH3OH(g)从体系中分离,平衡向正反应方向移动,CO转化率增大,故b正确;
c.充入He,使体系总压强增大,各物质的浓度不变,平衡不移动,CO转化率不变,故c错误;
d.使用高效催化剂,平衡不移动,CO的转化率不变,故d错误;
所以答案是:b;
(4)反应Ⅱ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)的平衡常数k= ![]() ;
;
保持恒温恒容,将反应Ⅱ的平衡体系中各物质浓度均增大为原来的2倍,相对于增大压强平衡向气体体积减小的方向移动即正向移动;平衡常数仅与温度有关,所以平衡常数KⅡ不变,
所以答案是: ![]() ;正向;不变.
;正向;不变.
【考点精析】解答此题的关键在于理解化学平衡状态本质及特征的相关知识,掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效),以及对化学平衡状态的判断的理解,了解状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】火法炼汞是在不太高的温度下(450~800℃),将汞矿石或精矿进行焙烧,直接将汞还原呈气态分离出来,而后冷凝成液态汞.目前工业上制粗汞的流程如图:

下列有关说法正确的是( )
A. 流程中加入氧化钙的目的是减少SO2的排放
B. “辰砂”加热时发生反应:HgS+O2 ![]() Hg+SO2,该方法属于热分解法
Hg+SO2,该方法属于热分解法
C. 洗涤粗汞时可用5%的盐酸代替5%的硝酸
D. 含汞烟气中汞的含量很低,可以直接排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.pH=2的硫酸溶液中c(H+):c(OH﹣)等于2:1,稀释100倍后二者的比值几乎不变
B.由水电离的c(H+)=10﹣12mol/L的溶液中:K+、Ba2+、Cl﹣、Br﹣、一定能大量共存
C.1.0×10﹣3mol/L盐酸溶液的pH=3,则1.0×10﹣8mol/L盐酸溶液的pH=8
D.某温度下水的离子积为1.0×10﹣12 , 若使pH=1的H2SO4溶液与pH=12的NaOH溶液混合后溶液呈中性,则两者的体积比为10:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁-空气电池的总反应方程式为:2Mg+O2+2H2O=2Mg(OH)2,其工作原理如图所示,下列说法不正确是( )
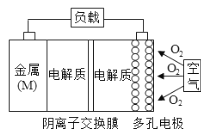
A. 反应过程中化学能转变成电能
B. 该电池的正极反应方程式为O2+4e-+2H2O=4OH-
C. 为防止负极区沉积Mg(OH)2,宜采用中性电解质及阴离子交换膜
D. 采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在迎接“绿色校园”的主题活动中,小明同学提出下列倡议,不可采纳的是( )
A.提倡绿色出行
B.提倡使用无磷洗涤剂
C.提倡使用一次性塑料袋
D.提倡垃圾分类和回收利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国医学家证实了三价铬离子(Cr3+)是构成葡萄糖耐量因子的重要组成部分,能够增强胰岛素的作用。构成葡萄糖耐量因子和蛋白质的元素有C、H、O、N、S、Cr等。
(1)Cr的价层电子排布式为__________________。
(2)O、N、S、Cr的第一电离能由大到小的顺序为___________________。
(3)SO2分子的VSEPR模型的名称为_________,SO32-离子中心原子的杂化方式为_________。
(4)CO2分子立体构型的名称为_________,它的等电子体中属于分子的有_________(任写一种)。
(5)实验式为CrCl3·6H2O的化合物有三种异构体,其中一种可表示为[Cr(H2O)4Cl2]Cl·H2O,该物质配离子中提供孤电子对的原子为_________,配位数为_________。
(6)NH3分子可以与H+结合生成NH4+,这个过程发生改变的是_________(填序号)。
a.微粒的空间构型 b.N原子的杂化类型 c.H-N-H的键角 d.微粒的电子数
(7)由碳元素形成的某种晶体的晶胞结构如图所示,若阿伏加德罗常数的值为NA,晶体密度为pg/cm3,则该晶胞的棱长为_________pm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)有下列六种物质:①碳60(C60)晶体②硼晶体③Na2O晶体④CaF2晶体⑤P4O10晶体⑥碳化硅晶体.其中属于离子晶体的是 , 属于分子晶体的是 , 属于原子晶体的是 .
(2)有下列分子:HCN、P4、SO2、PCl3、BF3 , 其中属于非极性分子的是 .
(3)有下列离子:SO32﹣、SO42﹣、CO32﹣ , 其中空间构型为正四面体形的是 , 中心原子的杂化轨道类型属于sp2杂化的是 .
(4)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为;与每一个钙离子距离最近并且距离相等的钙离子有个.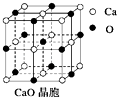
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在学习元素化合物知识的过程中,发现含有相同元素的物质间在一定条件下存在转化规律,绘制如下转化关系图,图中A、B、C、D是由短周期元素组成的物质。

请回答:
(1)若A为单质,其焰色反应为黄色,C为淡黄色固体。
①组成A的元素在周期表中的位置是___________。
②下列说法正确的是___________(填字母)。
a. A可经一步反应转化为D
b. B、C均可作呼吸面具的供氧剂
c. B、C、D均可与CO2反应
(2)若A为能使湿润的红色石蕊试纸变蓝的气体,C为红棕色气体。
①C→D反应的化学方程式是___________。
②A与C反应生成E和水,E是空气中含量最多的气体。当生成19.6gE时,转移电子的物质的量为_________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com