
【题目】在迎接“绿色校园”的主题活动中,小明同学提出下列倡议,不可采纳的是( )
A.提倡绿色出行
B.提倡使用无磷洗涤剂
C.提倡使用一次性塑料袋
D.提倡垃圾分类和回收利用
科目:高中化学 来源: 题型:
【题目】四氧化三铅(Pb3O4,也可写作2PbO·PbO2)俗名“铅丹”或“红丹”,可用作防锈剂。工业上以废旧铅酸电池的铅膏(主要成分是PbSO4和PbO2)为原料制备Pb3O4的流程如下:
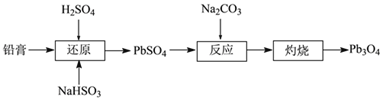
(1)“还原”时的化学方程式为________。
(2)已知:Ksp[PbCO3]=1.5×10-13。若使溶液中Pb2+的浓度小于1×10-5 molL-1,此时溶液中的c(CO32-) > ________molL-1。
(3)为测定某样品四氧化三铅含量,称取样品0.1200g,加入足量的6 molL-1HNO3充分溶解,过滤,得到含Pb2+的滤液和PbO2固体。将固体PbO2连同滤纸一并置于另一只锥形瓶中,加入足量的醋酸和醋酸钠混合溶液,再加入过量KI,使PbO2充分氧化I-,以淀粉溶液作指示剂,用0.01000molL-1 Na2S2O3溶液滴定,终点时用去30.00 mL。已知:I2 + 2Na2S2O3 = Na2S4O6 + 2NaI。
①所加KI必须过量,原因是________。
②计算试样中Pb3O4的质量分数_____。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】膜技术原理在化工生产中有着广泛的应用,有人设想利用电化学原理制备少量硫酸和绿色硝化剂N2O5,装置图如下。下列说法不正确的是
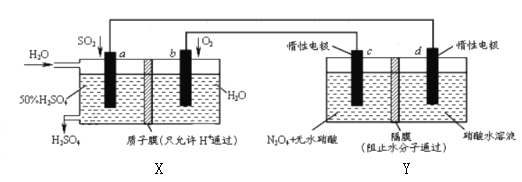
A. X是原电池,能够生产硫酸;Y是电解池,能够生产N2O5
B. C电极的电极反应方程式为N2O4+2HNO3-2e-=2N2O5+2H+
C. 当电路中通过2mole,X、Y中各有2molH+从左边迁移到右边
D. 电路中电子流向为a![]() d
d![]() c
c![]() b
b![]() a形成闭合回路
a形成闭合回路
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得,反应原理为:
①Na2CO3+SO2=Na2SO3+CO2
②Na2S+SO2+H2O=Na2SO3+H2S
③2H2S+SO2=3S↓+2H2O
④Na2SO3+ S ![]() Na2S2O3,
Na2S2O3,
常温下溶液中析出晶体为Na2S2O35H2O。Na2S2O3·5H2O于40~45℃熔化,48℃分解;Na2S2O3 易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如图所示。

Ⅰ.现按如下方法制备Na2S2O3·5H2O:
将硫化钠和碳酸钠按反应要求比例一并放入三颈烧瓶中,注入150mL蒸馏水使其溶解,在分液漏斗中,注入浓盐酸,在装置2中加入亚硫酸钠固体,并按下图安装好装置。
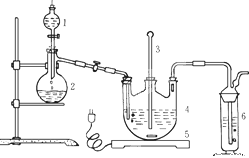
请问:(1)仪器2的名称为________,装置6中可放入_________。
A.BaCl2溶液 B.浓H2SO4
C.酸性KMnO4溶液 D.NaOH溶液
(2)打开分液漏斗活塞,注入浓盐酸使反应产生的二氧化硫气体较均匀的通入Na2S和Na2CO3的混合溶液中,并用磁力搅拌器搅动并加热。随着二氧化硫气体的通入,看到溶液中有大量浅黄色固体析出。持续通二氧化硫气体,反应约半小时。当溶液中pH接近或不小于7时,即可停止通气和加热。溶液pH要控制不小于7理由是________(用离子方程式表示)。
Ⅱ.分离Na2S2O3·5H2O并标定溶液的浓度:

(1)为减少产品的损失,操作①为______,操作②是_____、洗涤、干燥,其中洗涤操作是用_________(填试剂)作洗涤剂。
(2)蒸发浓缩滤液直至溶液呈微黄色浑浊为止,蒸发时为什么要控制温度不宜过高_______。
(3)称取一定质量的产品配制成硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:用分析天平准确称取基准物质K2Cr2O7(摩尔质量294g/mol)0.5880克。平均分成3份分别放入3个锥形瓶中,加水配成溶液,并加入过量的KI并酸化,发生下列反应:![]() 6I-+Cr2O72-+14H+=3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应: I2+2S2O32-=2I-+S4O62-,滴定终点的现象为_____________________。三次消耗Na2S2O3溶液的平均体积为20.00mL,则所标定的硫代硫酸钠溶液的浓度为_________ mol/L。
6I-+Cr2O72-+14H+=3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应: I2+2S2O32-=2I-+S4O62-,滴定终点的现象为_____________________。三次消耗Na2S2O3溶液的平均体积为20.00mL,则所标定的硫代硫酸钠溶液的浓度为_________ mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于脂质的叙述中错误的是 ( )
A.脂肪是重要的储能物质,同质量的脂肪中含有比糖类更多的能量
B.脂质中的磷脂是构成细胞膜的主要成分之一
C.有的脂质可以由内分泌腺分泌,如性激素
D.胆固醇对生命活动具有一定的调节作用,所以它既是脂质也是激素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上一般采用下列两种反应合成甲醇.
反应Ⅰ:CO(g)+2H2(g)CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H2
下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K):
温度 | 250℃ | 300℃ | 350℃ |
K | 2.0 | 0.27 | 0.012 |
(1)在一定条件下将2mol CO和6mol H2充入2L的密闭容器中发生反应Ⅰ,5min后测得c(CO)=0.4mol/L,计算可得此段时间的反应速率(用H2表示)为mol/(Lmin).
(2)由表中数据判断△H10 (填“>”、“<”或“=”);
反应CO2(g)+H2(g)CO(g)+H2O(g)△H3= (用△H1和△H2表示).
(3)若容器容积不变,则下列措施可提高反应Ⅰ中CO转化率的是 (填字母序号).
a.充入CO,使体系总压强增大 b.将CH3OH(g)从体系中分离
c.充入He,使体系总压强增大 d.使用高效催化剂
(4)写出反应Ⅱ的化学平衡常数表达式:KⅡ=;保持恒温恒容,将反应Ⅱ的平衡体系中各物质浓度均增大为原来的2倍,则化学平衡移动(填“正向”、“逆向”或“不”),平衡常数KⅡ(填“变大”、“变小”或“不变”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是( )
A.反应物的总能量低于生成物的总能量时,该反应必须加热才能发生
B.2H2(g)+O2(g)=2H2O(l);△H=﹣571.6kJmol﹣1 , 则氢气燃烧热为285.8kJmol﹣1
C.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.65kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l)△H=﹣57.3kJmol﹣1
D.已知2SO2(g)+O2(g)2SO3(g);△H=﹣QkJmol﹣1(Q>0),则将16gSO2(g)和足量O2置于一密闭容器中,充分反应后放出0.25QkJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究物质的微观结构,有助于人们理解物质变化的本质。
(1)N、Al、Si、Zn四种元素中,有一种元素的电离能数据如下:
电离能 | I1 | I2 | I3 | I4 | I5 | …… |
Im/kJ·mol-1 | 578 | 1817 | 2745 | 11575 | 14830 | …… |
则该元素是______(填元素符号)。
(2)氮元素可以形成许多化合物,在我们生活生产中有广泛的应用。
①维生素B4结构如图所示,则碳原子的轨道杂化类型是_________;1 mol维生素B4分子中含有σ键的数目为________。
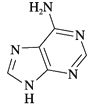
②NF3的空间构型为______(用文字描述);与NF3分子互为等电子体的阴离子为______(填化学式)。
(3)过渡元素常与H2O、NH3、CN-、SCN-等形成配合物。
①C、N、O三种元素的电负性由大到小的顺序为________。
②X、Y均为第四周期元素。X基态原子的内层轨道全部排满电子,且最外层电子数为1。Y基态原子在同周期元素中未成对电子数最多,则X+基态核外电子排布式________;元素Y在周期表中位于第________族。
③在配离子[Fe(SCN)]2+中,提供空轨道的是________;[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键,则[Zn(CN)4]2-的结构可用示意图表示为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com