
����Ŀ��ij�о���ѧϰС������ȷ�Ӧʵ��չ���о������и��л�ѧ�̲��ж������ȷ�Ӧ��������������������������Ӧ�ų��������ȣ�������ҫ�۵Ĺ�â������ֽ©�����²����մ���������������ɳ���������ġ���ѧ�ֲᡷ֪��Al��Al2O3��Fe��Fe2O3�۵㡢�е��������£�
���� | Al | Al2O3 | Fe | Fe2O3 |
�۵�/�� | 660 | 2054 | 1535 | 1462 |
�е�/�� | 2467 | 2980 | 2750 | -- |
������1��ijͬѧ�Ʋ⣬���ȷ�Ӧ���õ���������Ӧ�������Ͻ������ǣ��÷�Ӧ�ų�������ʹ���ۻ����������۵�����ͣ���ʱҺ̬���������ۺ��γ������Ͻ�����Ϊ���Ľ����Ƿ��������_____ ��������������������������
��2�����һ����ʵ�鷽����֤���������õĿ�״�������к��н���������ʵ�������Լ���_____ ����Ӧ�����ӷ���ʽΪ____ __��
��3��ʵ�����ܽ������������Լ�����õ���___ ___������ţ���
A��Ũ���� B��ϡ���� C��ϡ���� D������������Һ
����ʵ���о����֣����ᷢ��������ԭ��Ӧʱ�������Ũ��Խϡ����Ӧ��ԭ�����е�Ԫ�صĻ��ϼ�Խ�͡�ijͬѧȡһ������������������һ������ϡ�������ַ�Ӧ����Ӧ������������ų����ڷ�Ӧ���������Һ�У���μ���4molL-1������������Һ����������������Һ�������mL��������ij��������ʵ�����mol���Ĺ�ϵ��ͼ��ʾ���Իش��������⣺
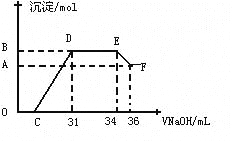
��4��ͼ��OC��û�г������ɣ��˽η�����Ӧ�����ӷ���ʽΪ____ __
��5����DE�Σ����������ʵ���û�б仯����˽η�����Ӧ�����ӷ���ʽΪ____ _ ����������˵����Һ��_____ _���OH����������___ ___ǿ�������ӷ��ţ���
��6��B���Ӧ�ij��������ʵ���Ϊ____ __mol��C���Ӧ������������Һ�����Ϊ____ __mL��
���𰸡�����1������
��2��NaOH��Һ��2Al+2OH��+H2O=2AlO2��+3H2����
��3��B��
����4��H++OH���TH2O
��5��NH4++OH���TNH3H2O��Al3+��Fe3+��H+��NH4+��
��6��0.032��7��
���������������������1�������۵�����ͣ���������Һ̬��һ����䵽ʢ��ɳ�ӵ��������γɺϽ��������ȷ�Ӧ���õ����������������Ͻ����Ժ�������2����������������Һ��Ӧ�������壬���Կ������������Ƽ������õ����������Ƿ���������Ӧ����ʽΪ2Al+2OH��+H2O=2AlO2��+3H2������3��A��Ũ������ʹ�����ۻ�������ʹ�Ͻ��ܽ⣬����B�����ý�����ϡ���ᷴӦ����������ܽ���ϡ�����У���ȷ��C��ϡ�����������Ӧ������Ⱦ�����壬�������ѡ����D���������������Ʒ�Ӧ�����ܽ�������ȫ���ܽ⣬��������ѡB������4��O��C֮�䷢���ķ�Ӧ������кͷ�Ӧ�����ӷ���ʽΪH++OH���TH2O ����5��DEһ�γ���������û�б仯���÷�ӦΪ笠����������������ӽ������һˮ�ϰ�������ʽΪNH4++OH���TNH3H2O����������˵����Һ�����Ƚ�����������ӵ��������ӣ�Ȼ��Ϊ�����Ӻ������ӣ���������������ӵ���笠����ӣ�������Һ�е����ӽ�����������ӵ�������ǿ���������ӣ�������Ϊ笠����ӡ���6����ͼ��֪��EF�����ĵ�����������ҺΪ36-34=2mL���ü���μ���Ӧ���������Ƶ����ʵ���Ϊ0.002��4=0.008mol�����ݷ���ʽ���㣬�������������ʵ���Ϊ0.008Ħ������������������Ϊ0.008Ħ��������Ϊxmol����Ϊ0.008mol�����ɵ������Ϊ��34-31����0.001��4=0.012mol�������������������Ӧ�������������ɵ����غ������3x+0.008��3=0.012��3 x=0.024mol������Ӧ�����������������ʵ���Ϊ0.024mol�����ɳ����������ʵ���Ϊ0.008+0.024=0.032mol���μ������������Ϊ31mLʱ�������Ӻ������Ӻ������Ӷ���Ӧ����C������������Һ�����Ϊ0.031-0.024��3/4-0.008��3/4="0.00" 7L����7mL��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʾ��ͼ��ʾ��ȷ����

A. Aͼ��ʾFe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ��H1=+26.7kJ/mol��Ӧ�������仯
B. Bͼ��ʾ̼��ȼ����
C. Cͼ��ʾʵ��Ļ����¶�20�棬�����ʵ���Ũ����ȡ�����ֱ�ΪV1��V2��H2SO4��NaOH��Һ��ϣ��������Һ�¶ȣ������ͼ(��֪:V1+V2=60mL)
D. Dͼ��֪�ȶ���˳��:B![]() B
B![]() C���ɣ���Ӧ�����е������仯������ͼ(E1��E3��ʾ����Ӧ�Ļ��)
C���ɣ���Ӧ�����е������仯������ͼ(E1��E3��ʾ����Ӧ�Ļ��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���в���ȷ����
A.���³�ѹ��������һ�ֻ�ɫ�IJ�����ˮ�Ĺ���
B.��Ԫ������Ȼ���еĴ��ڼ��л���̬��������̬����
C.�������Ӧ����������
D.���ڹ����������е�ȼ�ղ�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������һ�����⽫��̫�ս�����ļ���װ�ã���̫�����ɼ������ڷֽ⺣ˮ���⣬�䷴Ӧ�ɱ�ʾΪ��2H2O ![]() 2H2��+O2���������м���˵����
2H2��+O2���������м���˵����
��ˮ�ֽⷴӦ�Ƿ��ȷ�Ӧ��
��������һ����Դ��
��ʹ��������ȼ�������ڿ�������ЧӦ��
���������ɵ�����������ж���Ķ�����̼��Ӧ���ɼ״������������ɸ�������������
����������ȷ���ǣ�������
A.�٢�
B.�ڢ�
C.�ۢ�
D.�٢ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���ǣ�������
A.pH=2��������Һ��c��H+����c��OH��������2��1��ϡ��100������ߵı�ֵ��������
B.��ˮ�����c��H+��=10��12mol/L����Һ�У�K+��Ba2+��Cl����Br����һ���ܴ�������
C.1.0��10��3mol/L������Һ��pH=3����1.0��10��8mol/L������Һ��pH=8
D.ij�¶���ˮ�����ӻ�Ϊ1.0��10��12 �� ��ʹpH=1��H2SO4��Һ��pH=12��NaOH��Һ��Ϻ���Һ�����ԣ������ߵ������Ϊ10��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£�H2��g��+CO2 ��g��H2O��g��+CO��g����ƽ�ⳣ��K= ![]() �����¶����ڼס��ҡ������������ܱ������У�Ͷ��H2 ��g����CO2 ��g��������ʼŨ�������ʾ�������жϲ���ȷ���ǣ�������
�����¶����ڼס��ҡ������������ܱ������У�Ͷ��H2 ��g����CO2 ��g��������ʼŨ�������ʾ�������жϲ���ȷ���ǣ�������
��ʼŨ�� | �� | �� | �� |
c��H2��/molL��1 | 0.010 | 0.020 | 0.020 |
c��CO2��/molL��1 | 0.010 | 0.010 | 0.020 |
A.ƽ��ʱ������CO2��ת���ʴ���60%
B.ƽ��ʱ�����кͱ���H2��ת���ʾ���60%
C.ƽ��ʱ������c��CO2���Ǽ��е�2������0.008 molL��1
D.��Ӧ��ʼʱ�����еķ�Ӧ������죬���еķ�Ӧ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��þ-������ص��ܷ�Ӧ����ʽΪ��2Mg+O2+2H2O=2Mg(OH)2���乤��ԭ����ͼ��ʾ������˵������ȷ���� ��
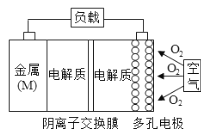
A. ��Ӧ�����л�ѧ��ת��ɵ���
B. �õ�ص�������Ӧ����ʽΪO2+4e-+2H2O=4OH-
C. Ϊ��ֹ����������Mg(OH)2���˲������Ե���ʼ������ӽ���Ĥ
D. ���ö�缫��Ŀ������ߵ缫��������Һ�ĽӴ��������������������ɢ���缫����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ˮ��Һ�еĵ��뷽��ʽ��
��NaHCO3__________
��NaHSO4_______________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ȡ������˵����ȷ����
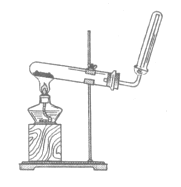
A. ��װ�ÿ������Ȼ�狀���ʯ����ȡ����
B. ��װ�ò����İ���������Ũ�������
C. ��ʪ����������Թܿڣ���ֹ������ɢ
D. ��պ��Ũ����IJ����������Թܿ�����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com