
【题目】加0.1 mol MnO2粉末于50 mL过氧化氢溶液(H2O2 , ρ=1.1 g·mL-1)中,在标准状况下放出气体的体积和时间的关系如图所示。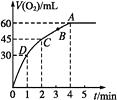
(1)实验时放出气体的总体积是。
(2)放出一半气体所需时间为。
(3)A、B、C、D各点反应速率由快到慢的顺序为。
(4)解释反应速率变化的原因。
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是
A.同周期元素中,ⅦA族元素的原子半径最大
B.ⅥA族元素的原子,其半径越大,越容易得到电子
C.室温时,0族元素的单质都是气体
D.元素周期表中从ⅢB到ⅡB这8个纵行的元素都是金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是

A. 若A为浓H2SO4,B为Na2SO3,C中盛有Na2SiO3溶液,C中溶液出现白色沉淀,证明非金属性S>Si
B. 若A为浓盐酸,B为MnO2,C中盛有KI淀粉溶液,C中溶液变蓝色
C. 若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,C中先产生白色沉淀后沉淀又溶解
D. 若A为H2O2,B为MnO2,C中盛有Na2S溶液,C中溶液变浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ:Zn—MnO2干电池应用广泛,其电解质溶液是ZnCl2—NH4Cl混合溶液。
(1)该电池的负极材料是________。电池工作时,电子流向________(填“正极”或“负极”)。
(2)ZnCl2—NH4Cl混合溶液中含有杂质Cu2+,会加速其电极的腐蚀,其主要原因是_________________________________________。欲除去Cu2+,最好选用下列试剂中的________(填选项)。
A.NaOH B.Zn C.Fe D.NH3·H2O
(3)此废旧电池的处理方法是回收,目的是为了_________________________。
(4)若有6.5g锌溶解,则流过外电路的电子的物质的量是___________ mol。
Ⅱ:向FeI2溶液中不断通入Cl2,溶液中I-、I2、IO3-、Fe2+、Fe3+等粒子的物质的量随n(Cl2):n(FeI2)的变化可用下图简单表示:
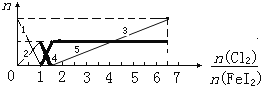
(1)粗线5、细线3分别代表哪种粒子的物质的量随n(Cl2):n(FeI2)变化的情况(填写
粒子化学式)___________、________________。
(2)当n(Cl2):n(FeI2)=6时,溶液中n(Cl-):n(IO3-)=_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】长征2号火箭承担运载“神六”的使命,氕化锂、氘化锂、氚化锂可以作为启动长征2号(CZ2F)火箭的优良炸药。下列说法正确的是( )
A.LiH、LiD、LiT的摩尔质量之比为1:2:3
B.它们都是强氧化剂
C.H、D、T之间互称为同素异形体
D.它们都是强还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A(g)+ 4B(g)![]() C(g)+ D(g),在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
C(g)+ D(g),在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
A. vA=0.15mol/(L·min) B. vB=0.6 mol/(L·min)
C. vC=0.4 mol/(L·min) D. vD=0.01 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素原子半径与原子序数的关系图,下列说法正确的是( )

A. M的最高价氧化物对应水化物能分别与Z、R的最高价氧化物对应水化物反应
B. Y的单质能从含R简单离子的水溶液人中置换出R单质
C. X、N两种元素组成的化合物熔点很低
D. 简单离子的半径:Z<X< Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性锌锰电池是日常生活中消耗量最大的电池,其构造如图所示。
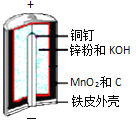
放电时总反应为:Zn + 2H2O + 2MnO2![]() Zn(OH)2 + 2MnOOH
Zn(OH)2 + 2MnOOH
从废旧碱性锌锰电池中回收Zn和MnO2的工艺如下:
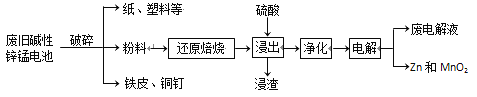
回答下列问题:
(1)MnOOH中,Mn元素的化合价为________。
(2)“还原焙烧”过程中,高价金属化合物被还原为低价氧化物或金属单质(其中MnOOH、MnO2被还原成MnO),主要原因是“粉料”中含有________。
(3)“净化”是为了除去浸出液中的Fe2+,方法是:加入________(填化学式)溶液将Fe2+氧化为Fe3+,再调节pH使Fe3+完全沉淀。(离子浓度小于1×10-5mol·L-1即为沉淀完全)已知浸出液中Mn2+、Zn2+的浓度约为0.1 mol·L-1,根据下列数据计算调节pH的合
理范围是________至________。
化合物 | Mn(OH)2 | Zn(OH)2 | Fe(OH)3 |
KSP近似值 | 10-13 | 10-17 | 10-38 |
(4)“电解”时,阳极的电极反应式为_____。本工艺中应循环利用的物质是_____(填化学式)。
(5)若将“粉料”直接与盐酸共热反应后过滤,滤液的主要成分是ZnCl2和MnCl2。“粉料”中的MnOOH与盐酸反应的化学方程式为________。
(6)某碱性锌锰电池维持电流强度0.5A(相当于每秒通过5×10-6 mol电子),连续工作80分钟即接近失效。如果制造一节电池所需的锌粉为6 g,则电池失效时仍有________%的金属锌未参加反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物的结构简式为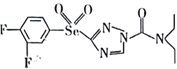 ,回答下列问题。
,回答下列问题。
(1)基态氧原子价层电子的轨道表达式(电子排布图)为_______________。该有机物组成元素中,电负性由大到小的前三种元素是___________________。(用元素符号回答,下同)
(2)该有机物中,中心原子杂化轨道类型为sp2的原子有___________________。
(3)KCN可被H2O氧化为KOCN (氰酸钾)。
①KOCN可作制药原料,其晶体类型是_________________,碳原了采取sp杂化,则1mol该物质中含有的π键数目为_______________。
②常温下H2O2是液体,沸点相对较高,其主要原因是_________________。
(4)H2SeO3的酸性___________H2SeO4 (填“强于”或“弱于”),原因是_______________。(从分子结构的角度回答)。
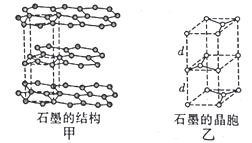
(5)石墨是碳的一种同素异形体,其晶体结构如图甲所示,虚线勾勒出的是其晶胞(如图乙)。则石墨晶胞中含碳原子数________个。已知石墨的密度为ρg·cm-3,C-C键的键长为rcm,设阿伏加德罗常数的值为NA,则石墨晶体的层间距为____________cm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com