
【题目】化学与生活、生产密切相关,下列说法错误的是( )
A.以电解饱和食盐水制取氯气等产品的工业称为“氯碱工业”
B.氯气可用来对自来水杀菌消毒
C.碘化银可用于人工降雨
D.为了消除碘缺乏病,在食用盐中加入一定量的碘单质
科目:高中化学 来源: 题型:
【题目】Ⅰ:Zn—MnO2干电池应用广泛,其电解质溶液是ZnCl2—NH4Cl混合溶液。
(1)该电池的负极材料是________。电池工作时,电子流向________(填“正极”或“负极”)。
(2)ZnCl2—NH4Cl混合溶液中含有杂质Cu2+,会加速其电极的腐蚀,其主要原因是_________________________________________。欲除去Cu2+,最好选用下列试剂中的________(填选项)。
A.NaOH B.Zn C.Fe D.NH3·H2O
(3)此废旧电池的处理方法是回收,目的是为了_________________________。
(4)若有6.5g锌溶解,则流过外电路的电子的物质的量是___________ mol。
Ⅱ:向FeI2溶液中不断通入Cl2,溶液中I-、I2、IO3-、Fe2+、Fe3+等粒子的物质的量随n(Cl2):n(FeI2)的变化可用下图简单表示:
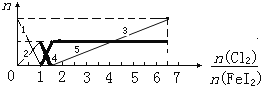
(1)粗线5、细线3分别代表哪种粒子的物质的量随n(Cl2):n(FeI2)变化的情况(填写
粒子化学式)___________、________________。
(2)当n(Cl2):n(FeI2)=6时,溶液中n(Cl-):n(IO3-)=_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性锌锰电池是日常生活中消耗量最大的电池,其构造如图所示。
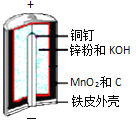
放电时总反应为:Zn + 2H2O + 2MnO2![]() Zn(OH)2 + 2MnOOH
Zn(OH)2 + 2MnOOH
从废旧碱性锌锰电池中回收Zn和MnO2的工艺如下:
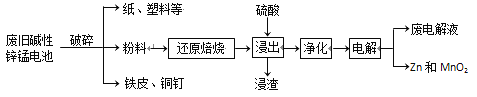
回答下列问题:
(1)MnOOH中,Mn元素的化合价为________。
(2)“还原焙烧”过程中,高价金属化合物被还原为低价氧化物或金属单质(其中MnOOH、MnO2被还原成MnO),主要原因是“粉料”中含有________。
(3)“净化”是为了除去浸出液中的Fe2+,方法是:加入________(填化学式)溶液将Fe2+氧化为Fe3+,再调节pH使Fe3+完全沉淀。(离子浓度小于1×10-5mol·L-1即为沉淀完全)已知浸出液中Mn2+、Zn2+的浓度约为0.1 mol·L-1,根据下列数据计算调节pH的合
理范围是________至________。
化合物 | Mn(OH)2 | Zn(OH)2 | Fe(OH)3 |
KSP近似值 | 10-13 | 10-17 | 10-38 |
(4)“电解”时,阳极的电极反应式为_____。本工艺中应循环利用的物质是_____(填化学式)。
(5)若将“粉料”直接与盐酸共热反应后过滤,滤液的主要成分是ZnCl2和MnCl2。“粉料”中的MnOOH与盐酸反应的化学方程式为________。
(6)某碱性锌锰电池维持电流强度0.5A(相当于每秒通过5×10-6 mol电子),连续工作80分钟即接近失效。如果制造一节电池所需的锌粉为6 g,则电池失效时仍有________%的金属锌未参加反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期非金属元素甲~戊在元素周期表中的相对位置如下表所示:
甲 | 乙 | |
丙 | 丁 | 戊 |
下列判断正确的是( )
A.原子半径:丙<丁<戊
B.非金属性:甲>丙
C.氧化物的水化物:丙<丁<戊
D.最外层电子数:甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学上常用AG表示溶液的lg 。25℃时,用0.100mol·L-1的NaOH溶液滴定20.00mL0.1mol·L-1的HNO2溶液。AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法不正确的是
。25℃时,用0.100mol·L-1的NaOH溶液滴定20.00mL0.1mol·L-1的HNO2溶液。AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法不正确的是
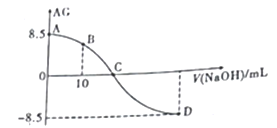
A. C点时,加入NaOH溶液的体积不为20mL
B. D点溶液的pH=11.25
C. B点溶液中存在2c(H+)-2c(OH-)=c(NO2-)-c(HNO2)
D. 25℃时,HNO2的电离常数Ka=1.0×10-5.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烯烃被酸性高锰酸钾溶液氧化的规律是,双键两端的基团=CH2变成CO2 , =CHR变成RCOOH, ![]() 变成
变成 ![]() ,现有某溴代烷A,分子式为C4H9Br,在NaOH醇溶液中加热得到有机物B,B被酸性高锰酸钾溶液氧化后不可能得到的产物是( )
,现有某溴代烷A,分子式为C4H9Br,在NaOH醇溶液中加热得到有机物B,B被酸性高锰酸钾溶液氧化后不可能得到的产物是( )
A.只有CH3COOH
B.CO2和 CH3COCH3
C.CO2和CH3CH2COOH
D.HCOOH和CH3CH2COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物的结构简式为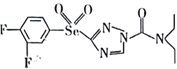 ,回答下列问题。
,回答下列问题。
(1)基态氧原子价层电子的轨道表达式(电子排布图)为_______________。该有机物组成元素中,电负性由大到小的前三种元素是___________________。(用元素符号回答,下同)
(2)该有机物中,中心原子杂化轨道类型为sp2的原子有___________________。
(3)KCN可被H2O氧化为KOCN (氰酸钾)。
①KOCN可作制药原料,其晶体类型是_________________,碳原了采取sp杂化,则1mol该物质中含有的π键数目为_______________。
②常温下H2O2是液体,沸点相对较高,其主要原因是_________________。
(4)H2SeO3的酸性___________H2SeO4 (填“强于”或“弱于”),原因是_______________。(从分子结构的角度回答)。
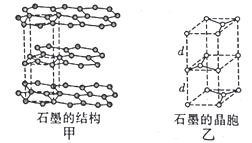
(5)石墨是碳的一种同素异形体,其晶体结构如图甲所示,虚线勾勒出的是其晶胞(如图乙)。则石墨晶胞中含碳原子数________个。已知石墨的密度为ρg·cm-3,C-C键的键长为rcm,设阿伏加德罗常数的值为NA,则石墨晶体的层间距为____________cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的除杂,下列说法正确的是( )
A.除去KNO3溶液中的少量KCl,加过量AgNO3溶液并过滤
B.除去CO气体中混有的少量CO2,可通过足量的灼热的CuO
C.通过蒸馏除去自来水中混有的各种盐以获得蒸馏水
D.通过分液除去酒精中混有的水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两个烧杯里的溶液为同浓度的稀硫酸,甲中G为电流计。经过一段时间后,以下说法中正确的是
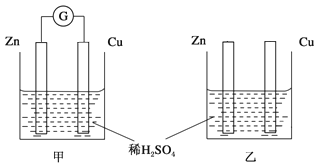
A. 两烧杯中铜片表面均无气泡产生
B. 甲中铜片是阳极,乙中铜片是负极
C. 甲中电子从锌片经溶液流向铜片,实现化学能转化为电能,而乙中实现化学能转化为热能
D. 产生气泡的速率甲比乙快
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com