
【题目】短周期非金属元素甲~戊在元素周期表中的相对位置如下表所示:
甲 | 乙 | |
丙 | 丁 | 戊 |
下列判断正确的是( )
A.原子半径:丙<丁<戊
B.非金属性:甲>丙
C.氧化物的水化物:丙<丁<戊
D.最外层电子数:甲>乙
 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
【题目】砷为第四周期第ⅤA族元素,依据它在周期表中的位置,推测砷不可能具有的性质是
A.砷在通常状况下为固体
B.砷的最高正化合价为+5
C.砷的最高价氧化物的水化物砷(H3AsO4)的酸性比磷酸(H3PO4)强
D.砷化氢(AsH3)不如氨气(NH3)稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Hg是水体污染的重金属元素之一。水溶液中二价汞的主要存在形态与C1-、OH-的浓度关系如图所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-lgc(Cl-)]。下列说法不正确的是
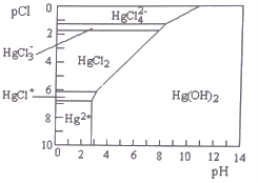
A. 可用如下方法除去污水中的Hg2+: FeS(s)+ Hg2+(aq)=HgS(s)+Fe2+(aq)
B. 当溶液pCl保持在1,pH在6~8时,汞元素主要以HgCl42-形式存在
C. HgCl2是一种强电解质,其电离方程式是:HgCl2=HgCl++Cl-
D. 当溶液pH保持在5,pCl由2改变至6时.可使HgCl2转化为Hg(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解尿素的碱性溶掖可以制取氢气,其装置如图所示(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极).下列有关说法中不正确的是( ) 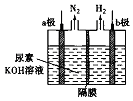
A.电解过穆中b极附近溶液碱性明显增强
B.溶液中的OH﹣逐渐向a极区附近移动
C.若在b极产生标准状况下224mL氢气,则消耗尿素2g
D.a极反应式为CO(NH2)2+8OH﹣﹣6e﹣═CO32﹣+N2↑+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非生物界中最丰富的元素是O、Si、Al、Fe,而生物体的细胞中含量最多的4种元素是C、H、O、N。这说明生物界与非生物界具有
A. 差异性 B. 多样性 C. 分割性 D. 隔绝性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联苄( ![]() )是一种重要的有机合成中间体,实验室可用苯和1,2一二氯乙烷(ClCH2CH2Cl)为原料,在无水AlCl3催化下加热制得,其制取步骤为:
)是一种重要的有机合成中间体,实验室可用苯和1,2一二氯乙烷(ClCH2CH2Cl)为原料,在无水AlCl3催化下加热制得,其制取步骤为:
(1)催化剂的制备:图1是实验室制取少量无水AlCl3的相关实验装置的仪器和药品: 
①将上述仪器连接成一套制备并保存无水AlCl3的装置,各管口标号连接顺序为:d接e,接 , 接 , 接 .
②有人建议将上述装置中D去掉,其余装置和试剂不变,也能制备无水AlCl3 . 你认为这样做是否可行(填“可行”或“不可行”),你的理由是 .
③装置A中隐藏着一种安全隐患,请提出一种改进方案: .
(2)联苄的制备 联苄的制取原理为: ![]()
反应最佳条件为n(苯):n(1,2﹣二氯乙烷)=10:1,反应温度在60﹣65℃之间.实验室制取联苄的装置如图2所示(加热和加持仪器略去):
实验步骤:
在三口烧瓶中加入120.0mL苯和适量无水AlCl3 , 由滴液漏斗滴加10.7mL1,2﹣二氯乙烷,控制反应温度在60﹣65℃,反应约60min.将反应后的混合物依次用稀盐酸、2%Na2CO3溶液和H2O洗涤分离,在所得产物中加入少量无水MgSO4固体,静止、过滤,先常压蒸馏,再减压蒸馏收集170~172℃的馏分,得联苄18.2g.
相关物理常数和物理性质如下表
名称 | 相对分子质量 | 密度/(gcm﹣3) | 熔点/℃ | 沸点/℃ | 溶解性 |
苯 | 78 | 0.88 | 5.5 | 80.1 | 难溶水,易溶乙醇 |
1,2一二氯乙烷 | 99 | 1.27 | ﹣35.3 | 83.5 | 难溶水,可溶苯 |
无水氯化铝 | 133.5 | 2.44 | 190 | 178(升华) | 遇水水解,微溶苯 |
联苄 | 182 | 0.98 | 52 | 284 | 难溶水,易溶苯 |
④仪器a的名称为 , 和普通分液漏斗相比,使用滴液漏斗的优点是 .
⑤洗涤操作中,水洗的目的是;无水硫酸镁的作用是 .
⑥常压蒸馏时,最低控制温度是 .
⑦该实验的产率约为 . (小数点后保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、生产密切相关,下列说法错误的是( )
A.以电解饱和食盐水制取氯气等产品的工业称为“氯碱工业”
B.氯气可用来对自来水杀菌消毒
C.碘化银可用于人工降雨
D.为了消除碘缺乏病,在食用盐中加入一定量的碘单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如下图所示,其中阴极和阳极均为惰性气体电极。测得同温同压下,气体甲与气体乙的体积比约为1:2,以下说法正确的是

A. a极与电源的负极相连
B. 产物丁为硫酸溶液
C. 离子交换膜d为阴离子交换膜(允许阴离子通过)
D. b电极反立式为2H2O+2e-=2OH-+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化镓(GaN)被称为第三代半导体材料,其应用已经取得了突破性的进展。
已知:(i)氮化镓性质稳定,不与水、酸反应,只在加热时溶于浓碱。
(ii)NiCl2 溶液在加热时,先转化为Ni(OH)2,后分解为NiO。
(iii)制备氮化镓的反应为:2Ga+2NH3![]() 2GaN+3H2
2GaN+3H2
某学校化学兴趣小组实验室制备氮化镓,设计实验装置如图所示:

设计实验步骤如下:
①滴加几滴NiCl2 溶液润湿金属镓粉末,置于反应器内。
②先通入一段时间后的H2,再加热。
③停止通氢气,改通入氨气,继续加热一段时间。
④停止加热,继续通入氨气,直至冷却。
⑤将反应器内的固体转移到盛有盐酸的烧杯中,充分反应过滤、洗涤、干燥。
(1)仪器X中的试剂是___________,仪器Y的名称是__________________。
(2)指出该套装置中存在一处明显的错误是________________________。
(3)步骤①中选择NiCl2 溶液,不选择氧化镍的原因是____________________。
a.增大接触面积,加快化学反应速率
b使镍能均匀附着在镓粉的表面,提高催化效率
c.为了能更好形成原电池,加快反应速率
(4)步骤③中制备氮化镓,则判断该反应接近完成时观察到的现象是____________________。
(5)请写出步骤⑤中检验产品氮化镓固体洗涤干净的操作________________________。
(6)镓元素与铝同族,其性质与铝类似,请写出氮化镓溶于热NaOH溶液的离子方程式:______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com