
����Ŀ���±�ΪԪ�����ڱ���һ���֣��밴Ҫ��ش����⣺
�� ���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
2 | �� | �� | �� | �� | �� | |||
3 | �� | �� | �� | �� |
��1������Ԫ��______�ķǽ�������ǿ��Ԫ��_____�Ľ�������ǿ����Ԫ�ط��ţ���
��2������Ԫ�آ۵�ԭ�ӽṹʾ��ͼ______��Ԫ�آ��γɵ��⻯��ĵ���ʽ___________��
��3������Ԫ�آܡ����γɵ��⻯����ȶ���˳��Ϊ_____���� �����ѧʽ����
��4������Ԫ�آ�͢������������Ӧˮ���������ǿ��Ϊ_____���� �����ѧʽ����
��5������Ԫ�آۡ��ܡ��ޡ��ߵ�ԭ�Ӱ뾶��СΪ____���� ������ ������ ����Ԫ�ط��ţ���
���𰸡� F Na ![]()
![]() HF�� ��HCl HClO4����H2SO4 Na����Mg����O����F
HF�� ��HCl HClO4����H2SO4 Na����Mg����O����F
����������Ԫ�������ڱ���λ�ÿ���֪��,��~���ֱ�ΪLi��C��O��F��Ne��Na��Mg��S��Cl��
(1)������֮��F�ķǽ�������ǿ��Na�Ľ�������ǿ��(2)O��ԭ������Ϊ8�����γɵ��⻯��ΪHCl��(3)�ǽ�����Խǿ����Ӧ�⻯��Խ�ȶ���(4)�ǽ�����Խǿ����Ӧ����������Ӧˮ���������Խǿ��(5)���Ӳ�Խ����ԭ�Ӱ뾶Խ����ͬ���ڴ�������ԭ�Ӱ뾶��С��
��Ԫ�������ڱ���λ�ÿ���֪��,��~��ֱ�ΪLi��C��O��F��Ne��Na��Mg��S��Cl��
(1)����Ԫ��F�ķǽ�������ǿ,Ԫ��Na�Ľ�������ǿ,��ˣ�������ȷ����:F;Na;
(2)O��ԭ�ӽṹʾ��ͼΪ![]() ��Ԫ�����γɵ��⻯��ΪHCl�������ʽΪ
��Ԫ�����γɵ��⻯��ΪHCl�������ʽΪ![]() ����ˣ�������ȷ������
����ˣ�������ȷ������![]() ��
��![]() ��
��
(3)����Ԫ���ܡ����γɵ��⻯����ȶ���˳��ΪHF>HCl����ˣ�������ȷ����:HF��HCl��
(4)����Ԫ��������������������Ӧˮ���������ǿ��ΪHClO4>H2SO4����ˣ�������ȷ����: HClO4��H2SO4��
(5)����Ԫ���ۡ��ܡ��ޡ�����ԭ�Ӱ뾶��СΪNa>Mg>O>F����ˣ�������ȷ����:Na��Mg��O��F��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ũ����������������ˮ�������������ڷ�������˵����ׯ���� �� ��
A��ˮ��ׯ��ûӰ�� B��ˮ�����õ��ڷ�������
C��ˮ������С�ڷ������� D��ˮ�����ô��ڷ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ��Ԫ�ص�ԭ�Ӽ䷴Ӧ�����γ����Ӽ�( )
ԭ�� | a | b | c | d | e | f | g |
M������� | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
A.a��cB.d��fC.d��gD.b��g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���100mL0.1mol/LNH4HSO4��Һ�еμ�0.1mol/L��NaOH��Һ��������ҺPH��NaOH��Һ����Ĺ�ϵ������ͼ��ʾ������˵����ȷ����

A. a��b��c��d�ĸ����У�ˮ�ĵ���̶�������d
B. a����Һ�У�c(NH3��H2O)+c(H+)=c(OH��)
C. b����Һ�У�c(Na+)+c(NH4+)=c(SO42��)
D. c����Һ�У�4c(Na+)= 3[c(SO42��) +c(NH4+)+ c(NH3��H2O)]
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Hg��ˮ����Ⱦ���ؽ���Ԫ��֮һ��ˮ��Һ�ж��۹�����Ҫ������̬��C1-��OH-��Ũ�ȹ�ϵ��ͼ��ʾ[ͼ�е����ʻ�����ֻ��Hg(OH)2Ϊ�����pCl=-lgc(Cl-)]������˵������ȷ����
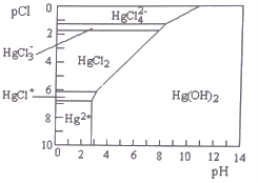
A. �������·�����ȥ��ˮ�е�Hg2+�� FeS(s)+ Hg2+(aq)=HgS(s)+Fe2+(aq)
B. ����ҺpCl������1��pH��6��8ʱ����Ԫ����Ҫ��HgCl42-��ʽ����
C. HgCl2��һ��ǿ����ʣ�����뷽��ʽ�ǣ�HgCl2=HgCl++Cl-
D. ����ҺpH������5��pCl��2�ı���6ʱ����ʹHgCl2ת��ΪHg(OH)2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ������ȷ���ǣ�������
A.������ĵ���ʽ�� ![]()
B.��ԭ�ӵĽṹʾ��ͼ�� 
C.�Ȼ��Ƶĵ��뷽��ʽ��NaCl=Na++Cl��
D.�Ҵ��Ľṹʽ��C2H6O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������صļ�����Ҵ������ȡ��������װ����ͼ��ʾ�������и�Ĥ����ֹ����ͨ��������������Ϊ���Ե缫���������й�˵���в���ȷ���ǣ������� 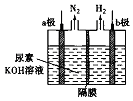
A.��������b��������Һ����������ǿ
B.��Һ�е�OH������a���������ƶ�
C.����b��������״����224mL����������������2g
D.a����ӦʽΪCO��NH2��2+8OH����6e���TCO32��+N2��+6H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����У� ![]() ����һ����Ҫ���л��ϳ��м��壬ʵ���ҿ��ñ���1��2һ�������飨ClCH2CH2Cl��Ϊԭ�ϣ�����ˮAlCl3���¼����Ƶã�����ȡ����Ϊ��
����һ����Ҫ���л��ϳ��м��壬ʵ���ҿ��ñ���1��2һ�������飨ClCH2CH2Cl��Ϊԭ�ϣ�����ˮAlCl3���¼����Ƶã�����ȡ����Ϊ��
��1���������Ʊ���ͼ1��ʵ������ȡ������ˮAlCl3�����ʵ��װ�õ�������ҩƷ�� 
�ٽ������������ӳ�һ���Ʊ���������ˮAlCl3��װ�ã����ܿڱ������˳��Ϊ��d��e���� �� �� �� �� ��
�����˽��齫����װ����Dȥ��������װ�ú��Լ����䣬Ҳ���Ʊ���ˮAlCl3 �� ����Ϊ�������Ƿ����������С������С�������������� ��
��װ��A��������һ�ְ�ȫ�����������һ�ָĽ������� ��
��2�����е��Ʊ� ���е���ȡԭ��Ϊ�� ![]()
��Ӧ�������Ϊn��������n��1��2���������飩=10��1����Ӧ�¶���60��65��֮�䣮ʵ������ȡ���е�װ����ͼ2��ʾ�����Ⱥͼӳ�������ȥ����
ʵ�鲽�裺
��������ƿ�м���120.0mL����������ˮAlCl3 �� �ɵ�Һ©���μ�10.7mL1��2���������飬���Ʒ�Ӧ�¶���60��65�棬��ӦԼ60min������Ӧ��Ļ����������ϡ���ᡢ2%Na2CO3��Һ��H2Oϴ�ӷ��룬�����ò����м���������ˮMgSO4���壬��ֹ�����ˣ��ȳ�ѹ�����ټ�ѹ�����ռ�170��172�����֣�������18.2g��
������������������������±�
���� | ��Է������� | �ܶ�/��gcm��3�� | �۵�/�� | �е�/�� | �ܽ��� |
�� | 78 | 0.88 | 5.5 | 80.1 | ����ˮ�������Ҵ� |
1��2һ�������� | 99 | 1.27 | ��35.3 | 83.5 | ����ˮ�����ܱ� |
��ˮ�Ȼ��� | 133.5 | 2.44 | 190 | 178�������� | ��ˮˮ�⣬�ܱ� |
���� | 182 | 0.98 | 52 | 284 | ����ˮ�����ܱ� |
������a������Ϊ �� ����ͨ��Һ©����ȣ�ʹ�õ�Һ©�����ŵ��� ��
��ϴ�Ӳ����У�ˮϴ��Ŀ��������ˮ����þ�������� ��
��ѹ����ʱ����Ϳ����¶��� ��
�߸�ʵ��IJ���ԼΪ �� ��С���������λ��Ч���֣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����pH= 1������ʹ�����Һ���ֱ��к͵�����������ʵ���Ũ�ȵ�����������Һ������������ǡ�ñ���ȫ�к�ʱ����������ʹ�����Һ������ֱ�Ϊx��y����x��y�Ĺ�ϵ��ȷ���ǣ� ��
A.x> y
B.x<y
C.x= y
D.x��y
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com