
I����֪��C(s)��H2O(g) CO(g)��H2(g) ��H
CO(g)��H2(g) ��H
һ���¶��£���1.0 L�ܱ������з���1 mol C��s����1 mol H2O(g)���з�Ӧ,��Ӧʱ��(t)��������������ѹǿ(p)�����ݼ��±���
| ʱ��t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| ��ѹǿp/100 kPa | 4.56 | 5.14 | 5.87 | 6.30 | 7.24 | 8.16 | 8.18 | 8.20 | 8.20 |
�ش��������⣺
(1)������Щѡ�����˵���ÿ��淴Ӧ�Ѵ�ƽ��״̬ ��
A�����������ܶȲ��ٷ����ı� B������1 mol H2O��g����ͬʱ����1 mol H2
C����H���� D��v��(CO) = v��(H2)
(2)����ѹǿP����ʼѹǿP0��ʾ��Ӧ��ϵ�������ʵ���n�ܣ�n�ܣ�____ mol���ɱ������ݼ��㷴Ӧ��ƽ��ʱ����Ӧ��H2O(g)��ת���ʦ� =_____����ȷ��С�����ڶ�λ����
�����ʼ��仯�����ڹ�ũҵ������������Ҫ��Ӧ�á�
(1)��֪25��ʱ��xSO2 (g)��2xCO(g)��2xCO2 (g)��Sx (s) ��H��ax kJ/mol
2xCOS(g)��xSO2 (g)��2xCO2 (g)��3Sx (s) ��H��bx kJ/mol��
��ӦCOS(g)����CO(g)��Sx (s)���Ȼ�ѧ����ʽ�� ��
(2)������ʵ���Ũ��Na2S��NaOH�����Һ�еμ�ϡ����������������H2S��HS−��S2−�ķֲ� ������ƽ��ʱij���ֵ�Ũ��ռ������Ũ��֮�͵ķ�������μ���������Ĺ�ϵ����ͼ��ʾ�����Եμӹ���H2S������ݳ������Է�����
������ƽ��ʱij���ֵ�Ũ��ռ������Ũ��֮�͵ķ�������μ���������Ĺ�ϵ����ͼ��ʾ�����Եμӹ���H2S������ݳ������Է�����
��B���ߴ��� �����仯(�������ű�ʾ)���μӹ����У���Һ��һ��������
c(Na+)= ��
��M�㣬��Һ����Ҫ�漰�����ӷ���ʽ ��
��֪ʶ�㡿��ѧƽ���ж������㡢�Ȼ�ѧ����ʽ����Һ�е�����Ũ��
���𰸽�����I��(1)AD (2)P/P0 79.82%����0.80��
II��(1)xCOS(g) = xCO(g)+ Sx(s) ��H=0.5(bx��ax)kJ/mol
(2)��HS�� c(Na+)=3[c(H2S)+c(HS��)+c(S2��)]���������غ�ó���
��c(Na+)= c(Cl��)+c(OH��)+c(HS��)+2c(S2��)��c(H+)���ɵ���غ�ó���
��M��2S2��+3H+=HS��+H2S
������I��(1)A����ӦΪ�ǵ��巴Ӧ�������������ı䣬������䣬���Ի��������ܶȲ��ٷ����ı�����ж�ƽ��״̬��B������1 mol H2O��g����ָ����Ӧ���ʣ�ͬʱ����1 mol H2��Ҳ������Ӧ���ʣ��ʴ���C����Hֻ�뷴Ӧ����ʽ�������йأ�������Ϊƽ���оݣ��ʴ��� D�����淴Ӧ������ȣ���ƽ�⣬��ȷ��
(2)��Ӧǰ���������ʵ���Ϊ1mol��ѹǿΪPo����Ӧ�������ʵ���Ϊn�ܣ�ѹǿΪP�����ݰ���٤�����ɣ���ͬ�����£��������ʵ���֮�ȵ���ѹǿ֮�ȣ�����n��= P/P0��
��2�� C(s)��H2O(g) CO(g)��H2(g)
CO(g)��H2(g)
��ʼ��mol�� 1 0 0 ��ʱѹǿP0=456KPa
�仯��mol�� x x x
ƽ�⣨mol�� 1-x x x ��ѹP=820KPa
��(x+1)/1=820/456 x=0.7982 ��Ӧ��H2O(g)��ת���ʦ� =79.82% ��
II��(1)���ø�˹���ɣ���xSO2 (g)��2xCO(g)��2xCO2 (g)��Sx (s) ��H��ax kJ/mol
��2xCOS(g)��xSO2 (g)��2xCO2 (g)��3Sx (s) ��H��bx kJ/mol
1/2��-1/2�ٵã�)xCOS(g) = xCO(g)+ Sx(s) ��H=0.5(bx��ax)kJ/mol
��2����������ʵ���Ũ��Na2S��NaOH�����Һ�еμ�ϡ����������������HS−Ũ��Ӧ����������С������B���ߴ���HS−�ı仯���μӹ����У���Һ���е���غ�������غ㣬�����غ㣺��ʼ�����ӵ����Ǻ������ӻ���ӵ�3������c(Na+)=3[c(H2S)+c(HS��)+c(S2��)]
����غ��У�c(Na+)= c(Cl��)+c(OH��)+c(HS��)+2c(S2��)��c(H+)��
��M��ʱ����Һ�������������Ũ����ȣ����ӷ���ʽΪ��2S2��+3H+=HS��+H2S
��˼·�㲦�������ۺϿ����˻�ѧƽ���ж������㡢�Ȼ�ѧ����ʽ����Һ�е�����Ũ�ȣ�ע�⣨1���з�Ӧ���ʵ�״̬��Ϊ�״��㣬�Ѷ��еȡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ijԭ�ӵ�Ħ��������Mg•mol��1����һ����ԭ�ӵ���ʵ����ԼΪ��������
| �� | A�� | M g | B�� | 1/M g | C�� | M/6.02��1023 g | D�� | 6.02��1023/M g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���ȷ�ӦCO(g)��H2O(g)  CO2(g)��H2(g)���¶�t1ʱ�ﵽƽ�⣬c1(CO)��c1(H2O)��1.0 mol��L��1����ƽ�ⳣ��ΪK1�����߷�Ӧ��ϵ���¶���t2ʱ����Ӧ���ƽ��Ũ�ȷֱ�Ϊc2(CO)��c2(H2O)��ƽ�ⳣ��ΪK2����
CO2(g)��H2(g)���¶�t1ʱ�ﵽƽ�⣬c1(CO)��c1(H2O)��1.0 mol��L��1����ƽ�ⳣ��ΪK1�����߷�Ӧ��ϵ���¶���t2ʱ����Ӧ���ƽ��Ũ�ȷֱ�Ϊc2(CO)��c2(H2O)��ƽ�ⳣ��ΪK2����
A��K2��K1�ĵ�λ��Ϊmol��L��1 B��K2��K1
C��c2(CO)��c2(H2O) D��c1(CO)��c2(CO)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��һ���ݻ��̶�Ϊ2 L���ܱ������У�������ӦaA(g)��bB(g) pC(g)����H��������Ӧ�����¼�����
pC(g)����H��������Ӧ�����¼�����
| ʱ�� | c(A) (mol��L��1) | c(B) (mol��L��1) | c(C) (mol��L��1) |
| 0 | 1 | 3 | 0 |
| ��2 min[ | 0.8 | 2.6 | 0.4 |
| ��4 min | 0.4 | 1.8 | 1.2 |
| ��6 min | 0.4 | 1.8 | 1.2 |
����ϸ���������ݱ������ݣ��ش��������⣺
(1)a��________��b��________��p��________��(ȡ��С������)
(2)��2 min����4 min��A��ƽ����Ӧ����v(A)��________ mol��L��1��min��1��
(3)���ӿ�ʼ���� 4 min����ƽ��ʱ��Ӧ�ų�������Ϊ235.92 kJ����÷�Ӧ�Ħ�H��________��
4 min����ƽ��ʱ��Ӧ�ų�������Ϊ235.92 kJ����÷�Ӧ�Ħ�H��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����������������������л���C12H18����ͬ���칹�����ĿΪ�������������칹��
A��39 B��42 C��45 D��48
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����˵���������
A�� PM2.5�ֳ�ϸ�������ָ��������ѧ����ֱ��С�ڵ���2.5�Ŀ������������С���������ǿ�������ж����к����ʣ����磬�ؽ���������ȣ��������彡���ʹ�������������Ӱ�����
B�� ��ˮ��ʯ������Ҫ���ܽ���CO2����ˮ��CaCO3�������ã������˿����Ե�Ca(HCO3)2
C�� ʳƷ��ȫ�ѳ�Ϊ�����������ڹ�ע���ȵ㻰�⣬�Ͻ���ʳƷ�������κη�ʳ�����ʺ�����ʳƷ���Ӽ�
D�� һ����̼�ж�������ú¯�ľ��ң��ɷ�������ˮ����������Ч������һ����̼���Է�ú���ж�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ʯ����Ҫ�ɷ���K2SO4��Al2(SO4)3��2Al 2O3��6H2O�������������Fe2O3���ʡ���������ʯ����ȡ������Al2O3��K2FeO4��H2SO4�Ĺ���������ͼ��ʾ��
��1�������ա�������Al2(SO4)3��S������Ӧ�Ļ�ѧ����ʽΪ ��
������102g Al2O3��ת�Ƶĵ�����ĿΪ ��
��2�����ɳ�����ʱ�����ӷ���ʽΪ ��
��3��д����ѧʽ���������� ��
��4����Һ�����������pH���ˣ�ϴ�ӣ��ɵó�����֤����������ϴ�Ӹɾ���ʵ������������� ��
��5������Һ�еõ�K2SO4����ķ����� ��
��6��K2FeO4Ҳ������Ϊ�缫��ͨ�����Ũ��KOH��Һ����ȡ��д����ⷨ��ȡK2FeO4��������ӦʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij�¶��£�����A�ı�����Һ����������Ϊa%���м���m����ˮ��A��ͬ��������n��A��xH2O���壬��ӱ�����Һ����������������Ϊ����Aʽ��ΪM�� �� ��
A��n��a% �� B��n-m ��C��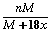 D����n-m����a%
D����n-m����a%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����˵������ȷ���� �� ��
A�������£�ij�������KspΪ2.5��105
B����ͭ����Ʒ�Ʋ����������Ʒ������ǰ����������
C��NH3��H2O��Һ��ˮϡ�ͺ���Һ��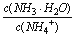 ��ֵ����
��ֵ����
D�������£�pH��Ϊ5���������Ȼ����Һ�У�ˮ�ĵ���̶���ͬ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com