
【题目】Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性环境下易分解生成S和SO2。某小组设计了如下实验装置制备Na2S2O3(夹持及加热仪器略),总反应为2Na2S+Na2CO3+4SO2 ![]() 3Na2S2O3+CO2。回答下列问题:
3Na2S2O3+CO2。回答下列问题:

(1)装置A的作用是制备______________,反应的化学方程式为______________。
(2)完成下表实验过程:
操作步骤 | 装置C的实验现象 | 解释原因 |
检查装置气密性后,添加药品 | pH计读数约为13 | 用离子方程式表示(以S2-为例): ① |
打开K2,关闭K3,调节K1使硫酸缓慢匀速滴下 | ⅰ.导管口有气泡冒出, ② ⅱ.pH计读数逐渐 ③ | 反应分步进行: Na2CO3+SO2 2Na2S+3SO2 Na2SO3+S |
当pH计读数接近7时,立即停止通SO2,操作是 ④ | 必须立即停止通SO2的原因是: ⑤ |
(3)Na2S2O3有还原性,可作脱氯剂。向Na2S2O3溶液中通入少量Cl2,某同学预测S2O32-转变为SO42-,设计实验验证该预测:取少量反应后的溶液于试管中,______________。
【答案】(1)SO2,H2SO4+Na2SO3![]() SO2↑+H2O+Na2SO4;
SO2↑+H2O+Na2SO4;
(2)①S2-+H2O![]() HS-+OH-;②溶液出现淡黄色浑浊,然后逐渐澄清(或浑浊减少);③减小;④关闭K1、K2,打开K3;⑤SO2过量会使溶液酸度增加,使产物分解,降低产率;(3)加入过量盐酸,过滤,向滤液中滴加BaCl2溶液,有白色沉淀生成。
HS-+OH-;②溶液出现淡黄色浑浊,然后逐渐澄清(或浑浊减少);③减小;④关闭K1、K2,打开K3;⑤SO2过量会使溶液酸度增加,使产物分解,降低产率;(3)加入过量盐酸,过滤,向滤液中滴加BaCl2溶液,有白色沉淀生成。
【解析】
试题分析:(1)根据装置A中原料,装置A发生Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,因此制备的是SO2;(2)①装置C盛放Na2S和Na2CO3,都属于强碱弱酸盐,S2-、CO32-发生水解,题目中以S2-为例,S2-+H2O![]() HS-+OH-,溶液显碱性;②根据反应分步的方程式,除有气泡冒出外,还有淡黄色沉淀产生,溶液变浑浊,然后溶液变澄清;③消耗S2-,S2-+H2O
HS-+OH-,溶液显碱性;②根据反应分步的方程式,除有气泡冒出外,还有淡黄色沉淀产生,溶液变浑浊,然后溶液变澄清;③消耗S2-,S2-+H2O![]() HS-+OH-,使反应向逆反应方向进行,c(OH-)降低,pH减小;④立即停止通SO2,操作是关闭K1、K2,打开K3;⑤Na2S2O3在中性或碱性环境中稳定,在酸性环境下易分解生成S和SO2,如果继续通入SO2,造成溶液显酸性,Na2S2O3分解,降低产率;(3)检验SO42-:先加盐酸酸化,然后再滴加BaCl2溶液,出现白色沉淀,说明含有SO42-,因此具体操作是:加入过量盐酸,过滤,向滤液中滴加BaCl2溶液,有白色沉淀生成。
HS-+OH-,使反应向逆反应方向进行,c(OH-)降低,pH减小;④立即停止通SO2,操作是关闭K1、K2,打开K3;⑤Na2S2O3在中性或碱性环境中稳定,在酸性环境下易分解生成S和SO2,如果继续通入SO2,造成溶液显酸性,Na2S2O3分解,降低产率;(3)检验SO42-:先加盐酸酸化,然后再滴加BaCl2溶液,出现白色沉淀,说明含有SO42-,因此具体操作是:加入过量盐酸,过滤,向滤液中滴加BaCl2溶液,有白色沉淀生成。


 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式不正确的是( )
A.向氯化铝溶液中滴加过量氨水,生成白色胶状沉淀:Al3++3NH3·H2O=Al(OH)3+3NH4+
B.加入足量的氢氧化镁以除去氯化镁溶液中的少量氯化铁:Fe3++3OH—=Fe(OH)3↓
C.常温下0.1mol/L氯化铵溶液pH=5:NH4++H2O![]() NH3·H2O+H+
NH3·H2O+H+
D.电解精炼铜时阳极铜溶解:Cu—2e—=Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验报告中记录下列数据,其中正确的是( )
A. 用25mL量筒量取12.36mL盐酸 B. 用托盘天平称量8.75g食盐
C. 用500mL容量瓶配制450mL溶液 D. 用广泛pH试纸测某溶液的pH为3.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、Na2O2与SO3(g)的反应类似于Na2O2与CO2(g)的反应,请写出Na2O2与SO3反应的化学方程式:_____________________。
Ⅱ、某学生课外活动小组模拟呼吸面具中的反应原理,设计用下图所示的仪器来制取氧气并测量氧气的体积。图中量气装置E由甲乙两根玻璃管组成,它们由橡皮管连通,并装入适量水。甲管有刻度(0~50mL)供量气用,乙管可上下移动调节液面高低。实验可供选用的药品还有:稀硫酸、盐酸、过氧化钠、碳酸钠、大理石、水。
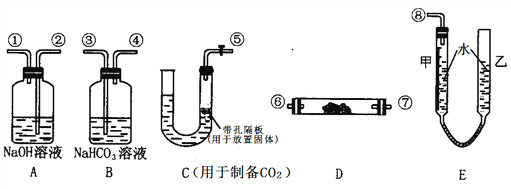
请回答下列问题:
(1)图中各装置接口连接顺序是_____________________(填各接口的编号,其中连接胶管及夹持装置均省略,):
→ → → ⑥ → ⑦ → → →
(2)装置D中发生反应的化学方程式为:_______________。
(3)装置B的作用是(用离子方程式表示):_______________。
(4)为了较准确测量氧气的体积,除了必须检查整个装置的气密性之外,在读反应前后甲管中液面的读数求其差值的过程中,还应注意_______(填字母编号)。
a.视线与液体凹液面最低处相平才读数
b.等待气体恢复常温才读数
c.上下移动乙管,使甲乙两管液面相平才读数
(5)实验测得收集的氧气在标准状况下体积为V L,则参与反应的Na2O2 的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 碳酸氢钙溶液中加入足量的氢氧化钠溶液:Ca2++2HCO![]() +2OH-= CaCO3↓+CO
+2OH-= CaCO3↓+CO![]() +2H2O
+2H2O
B. 澄清的石灰水与稀盐酸反应:Ca(OH)2 + 2H+ = Ca2+ + 2H2O
C. 向氢氧化钠溶液中滴入少量硫酸铝溶液:Al3+ +3OH- = Al(OH)3↓
D. 钠与CuSO4溶液反应:2Na + Cu2+ = 2Na+ + Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X2、Y2、Z2、W2四种物质的氧化能力W2>Z2>X2>Y2,下列氧化还原反应能发生的是
A.2NaW + Z2 = 2NaZ + W2 B.2NaW + X 2 = 2Na X + W2
C.2NaY + W2 = 2NaW + Y2 D.2NaZ + X2 = 2NaX + Z2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类是化学学习中经常用到的方法,下列对一些物质或化学反应的分类以及依据正确的是( )
A. H2SO4是酸,因为H2SO4中含有氢元素
B. 豆浆是胶体,因为豆浆中的分散质粒子直径在1nm~100nm之间
C. Na和H2O的反应不是离子反应,因为反应中没有离子参加
D. 燃烧必须有氧气参与,因而没有氧气参与的反应一定没有燃烧现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既属于氧化还原反应,又是吸热反应的是
A.锌粒与稀硫酸的反应
B.灼热的木炭与CO2反应
C.甲烷在氧气中的燃烧反应
D.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com