
【题目】已知有以下物质相互转化,A是生活中用量最大的金属。
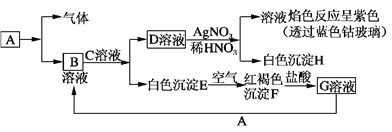
试回答:
(1)写出C的化学式________,H的化学式________。
(2)写出由E转变成F的化学方程式____________________________________。
(3)检验G溶液中的金属阳离子的方法是________________________________。
(4)写出A在一定条件下与水反应的化学方程式_______________________________________。
【答案】 KOH AgCl 4Fe(OH)2+O2+2H2O=4Fe(OH)3 取少量待测液于洁净试管中,滴加几滴KSCN溶液,如果溶液变为红色,则G溶液中的金属阳离子为Fe3+ 3Fe+4H2O(g) ![]() Fe3O4+4H2
Fe3O4+4H2
【解析】A是生活中用量最大的金属,则A为Fe,白色沉淀E在空气中转化为红褐色沉淀F,则E为Fe(OH)2,F为Fe(OH)3;F与盐酸反应得到G溶液,则G为FeCl3;G与A(Fe)生成B,则B为FeCl2;B溶液与C溶液反应生成D溶液和白色沉淀E[Fe(OH)2],则C是碱,D是氯化物;又因为D溶液与硝酸银反应生成溶液和白色沉淀H,则H为AgCl,溶液焰色反应呈紫色(透过蓝色钴玻璃),则溶液中含有K+,所以C为KOH、D为KCl。
(1)由上述分析可得,C的化学式KOH;H的化学式AgCl。
(2)E为Fe(OH)2、F为Fe(OH)3,Fe(OH)2与O2、H2O反应生成Fe(OH)3,化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3。
(3)G为FeCl3,可以用KSCN溶液来检验Fe3+,方法为:取少量待测液于洁净试管中,滴加几滴KSCN溶液,如果溶液变为红色,则溶液中含有Fe3+。
(4)铁在高温时与水蒸气反应生成Fe3O4和氢气,化学方程式为:3Fe+4H2O(g)![]() Fe3O4+4H2。
Fe3O4+4H2。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数与未成对电子数的比值为3:2.同时含有A、B、D三种元素的化合物M是一种居室污染气体,其分子中所有的原子共平面.A、B两种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.
请回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)下列叙述正确的是(填字母).
a.M易溶于水,是因为M是极性分子;N不溶于水,是因为N是非极性分子
b.M和二氧化碳分子中的中心原子均采用sp2杂化
c.N分子中含有6个σ键和3个π键
d.BD2晶体的熔、沸点都比二氧化硅晶体的低
(2)金属E的晶胞是面心立方结构(如图),则E晶体的1个晶胞中含E原子数为: , 距离E原子最近且等距离的E的原子数为: , 该晶胞中原子的空间利用率为 .
(3)X和Y分别是B和C与氢的化合物,这两种化合物都含有18电子.X和Y的化学式分别是、 . 两者沸点的关系为XY(“>”或“<”),原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A. 摩尔是国际单位制中七个基本物理量之一
B. 1molSO2的质量为64 g·mol-1
C. 12 g 12C中所含碳原子数即为阿伏加德罗常数
D. 气体的摩尔体积约为22.4 L·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某反应是放热反应,下列说法正确的是
A. 该反应中反应物的总能量大于生成物的总能量
B. 该反应中反应物的总能量小于生成物的总能量
C. 该反应发生时,一定不需要加热
D. 如果该反应开始时需加热,则一直要加热反应才能继续进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸性溶液中,Fe2+会被空气缓慢氧化为Fe3+。不同条件下,一定浓度的Fe2+的氧化率随时间变化关系如下图所示。下列有关说法正确的是

A. 该氧化过程的离子方程式为:Fe2++O2+4H+=Fe3++2H2O
B. pH=1.5时Fe2+的氧化率一定比pH=2.5时大
C. Fe2+的氧化率仅与溶液的pH和温度有关
D. 其他条件相同时,80℃时Fe2+的氧化率比50℃时大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com