
分析 (1)根据M(Sx)=ρVm计算出该硫单质的摩尔质量,再计算出其化学式;
(2)根据摩尔质量与密度成正比,M(Sx)=64×M(H2)计算出摩尔质量,再计算出其化学式.
解答 解:(1)M(Sx)=ρVm=11.43g•L-1×22.4L•mol-1≈256g•mol-1,即:32x=256,解得x=8,故其化学式为S8,故答案为:S8;
(2)摩尔质量与密度成正比,无色蒸气对氢气的相对密度(相同条件下)是64,则M(Sx)=64×2g•mol-1=128g•mol-1,即32x=128,x=4,故该单质的化学式为S4,故答案为:S4.
点评 本题考查了摩尔质量、相对分子量的计算,题目难度中等,注意摩尔质量与相对分子量的关系,该题是高考中的常见题型,旨在培养学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | 无论使用的石油、煤等传统能源,还是氢能、核能等新能源,归根结底这些能源都是由太阳能转而来 | |
| B. | 铝表面有一层致密的氧化物薄膜具有极强的抗腐蚀能力,故铝制容器可用来贮存酸碱性、腌制性食品等 | |
| C. | 生活中用草木灰制作松花蛋,农业上用福尔马林浸种,工业上用亚硝酸盐处理皮革等,其过程的共同点都是利用了蛋白质变性的性质 | |
| D. | 氯气、次氯酸盐、二氧化氯等含氯化合物都具有强氧化性,能用于杀菌消毒.氯化钾、氯酸钾也是含氯化合物,故也能用于杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
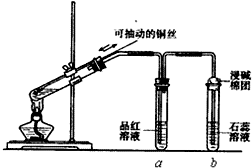 某同学设计实验证明铜与浓硫酸能发生反应,并检验生成气体的性质,如图所示,在试管里加入2mL浓硫酸,用带导管和一个小孔的胶管塞紧,从孔中插入一根铜丝,加热,把放出的气体依次通入品红溶液和石蕊溶液中.
某同学设计实验证明铜与浓硫酸能发生反应,并检验生成气体的性质,如图所示,在试管里加入2mL浓硫酸,用带导管和一个小孔的胶管塞紧,从孔中插入一根铜丝,加热,把放出的气体依次通入品红溶液和石蕊溶液中.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 化合物电离时,生成的阳离子是氢离子的是酸 | |
| B. | 化合物电离时,生成的阴离子是氢氧根离子的是碱 | |
| C. | 化合物电离时,生成金属阳离子和酸根离子的是盐 | |
| D. | NH4Cl是盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.05mol | B. | 0.1mol | C. | 0.2mol | D. | 0.04mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子个数之比为1:1 | B. | 物质的量之比为1:1 | ||
| C. | 体积之比为11:16 | D. | 分子数之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com