
| A. | 常温常压下,78g Na2O2含有的阴离子数为NA | |
| B. | 常温常压下,22.4 L氢气中含氢原子数目为2 NA | |
| C. | 0.5 mol/L的NaCl溶液中,含有Cl-数目为0.5 NA | |
| D. | 1mol Fe在足量氯气中完全反应,失去的电子数为2 NA |
分析 A.Na2O2由2个Na+和1个O22-构成;
B.气体摩尔体积的应用条件是标准状况;
C.溶液体积不知不能计算溶液中离子数;
D.铁和氯气反应生成氯化铁.
解答 解:A.78gNa2O2的物质的量n=$\frac{m}{M}$=$\frac{78g}{78g/mol}$=1mol,Na2O2由2个Na+和1个O22-构成,故1molNa2O2中含1mol阴离子,即NA个,故A正确;
B.气体摩尔体积的应用条件是标准状况,温度压强不知,22.4L氢气中物质的量不是1mol,故B错误;
C.溶液体积不知不能计算溶液中离子数,故C错误;
D.1molFe与氯气反应生成氯化铁,失去的电子数为3NA,故D错误;
故选A.
点评 本题考查了阿伏伽德罗常数的分析,主要是物质的量和微粒数的计算,气体摩尔体积条件应用,氧化还原反应实质的理解应用,题目难度中等.


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案科目:高中化学 来源: 题型:解答题
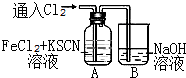 甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究.向A中通入氯气至过量,发现A中溶液先呈红色后逐渐变为黄色.
甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究.向A中通入氯气至过量,发现A中溶液先呈红色后逐渐变为黄色.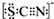 .则碳元素的化合价是+4
.则碳元素的化合价是+4查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3+3CO═2Fe+3CO2 | B. | Ca(OH)2+CO2═CaCO3↓+H2O | ||
| C. | CuO+H2═Cu+H2O | D. | 2Na+Cl2═2NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤⑥⑦ | B. | ①②③④⑥⑦ | C. | ①③⑤⑥⑦ | D. | 全有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠溶液应保存在带磨砂玻璃塞的无色细口瓶中 | |
| B. | 二氧化硅是制造光导纤维的材料 | |
| C. | 水玻璃可用作木材防火剂 | |
| D. | 氢氟酸能与二氧化硅反应,因此可用于刻蚀玻璃 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CH2=CH-CH2OH | B. | HO-CH2-CH2-CH2-COOH | ||
| C. | HNO3 | D. | 乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
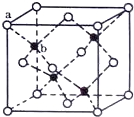 E、G、M、Q、T是五种原子序数依次增大的前四周期元素.E、G、M是位于p区的同一周期的元素,M的价层电子排布为ns2np2n,E与M原子核外的未成对电子数相等;QM2与GM2-具有相等的价电子总数;T为过渡元素,其原子核外没有未成对电子.请回答下列问题:
E、G、M、Q、T是五种原子序数依次增大的前四周期元素.E、G、M是位于p区的同一周期的元素,M的价层电子排布为ns2np2n,E与M原子核外的未成对电子数相等;QM2与GM2-具有相等的价电子总数;T为过渡元素,其原子核外没有未成对电子.请回答下列问题: .E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因:从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性
.E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因:从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油裂解得到的汽油是纯净物 | |
| B. | 石油分馏和煤干馏都是物理变化 | |
| C. | 煤干馏可以得到甲烷、苯和氨等重要化工原料 | |
| D. | 通过煤的液化得到水煤气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com