
【题目】实验室用图示装置制备KClO溶液,再与KOH、Fe(NO3)3溶液反应制备高效净水剂K2FeO4。

<查阅资料>Cl2与KOH溶液在20℃以下反应生成KClO,在较高温度下则生成KClO3;
K2FeO4易溶于水,微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定。
(1)仪器a的名称: ;装置C中三颈瓶置于冰水浴中的目的是 。
(2)装置B吸收的气体是 ,装置D的作用是 。
(3)C中得到足量KClO后,将三颈瓶上的导管取下,依次加入KOH溶液、Fe(NO3)3溶液,水浴控制反应温度为25℃,搅拌1.5 h,溶液变为紫红色(含K2FeO4),该反应的离子方程式为 。再加入饱和KOH溶液,析出紫黑色晶体,过滤,得到K2FeO4粗产品。
(4)K2FeO4粗产品含有Fe(OH)3、KCl等杂质,其提纯步骤为:
①将一定量的K2FeO4粗产品溶于冷的3 mol/L KOH溶液中。
②过滤。
③ 。
④搅拌、静置、过滤,用乙醇洗涤2~3次。
⑤在真空干燥箱中干燥。
(5)称取提纯后的K2FeO4样品0.2200 g于烧杯中,加入强碱性亚铬酸盐溶液,反应后再加稀硫酸调节溶液呈强酸性,配成250 mL溶液,取出25.00 mL放入锥形瓶,用0.01000 mol/L的(NH4)2Fe(SO4)2溶液滴定至终点,重复操作2次,平均消耗(NH4)2Fe(SO4)2溶液30.00 mL。涉及主要反应为:
Cr(OH)4-+FeO42- = Fe(OH)3↓+CrO42-+OH-
2CrO42-+2H+![]() Cr2O72-+H2O
Cr2O72-+H2O
Cr2O72-+6Fe2++14H+ = 6Fe3++2Cr3++7H2O
则该K2FeO4样品的纯度为 。
【答案】(1)分液漏斗; 防止Cl2与KOH反应生成KClO3;
(2)HCl 吸收Cl2,防止污染空气;
(3)3ClO-+2Fe3++10OH-==2FeO42-+3Cl-+5H2O;
(4)将滤液置于冰水浴中,向滤液中加入饱和KOH溶液;(5)90% ;
【解析】
试题分析:(1)仪器a的名称是分液漏斗;Cl2与KOH溶液在20℃以下反应生成KClO,在较高温度下则生成KClO3,冰水浴的目的是防止Cl2与KOH反应生成KClO3 ;
(2)浓HCl具有挥发性,故装置B吸收的气体是HCl;因为装置A中会不断产生Cl2,装置D的作用是吸收Cl2,防止污染空气;
(3)KClO具有强氧化性,氧化铁离子的反应方程式为:3ClO-+2Fe3++10OH-==2FeO42-+3Cl-+5H2O;
(4)K2FeO4易溶于水、所以先过滤除去Fe(OH)3,K2FeO4又微溶于浓KOH溶液,而且在0℃~5℃的强碱性溶液中较稳定,再将滤液置于冰水浴中,向滤液中加入饱和KOH溶液,得到K2FeO4晶体;
(5)FeO42- →Fe(OH)3↓,Fe2+→Fe3+ ,根据得失电子守恒:25c×(6-3)=30×0.01×(3-2), 求得c=0.004mol/L,250×10-3×0.004×(39×2+56+16×4)÷0.22=90%。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 植物油通过取代反应可转化为人造脂肪
B. 葡萄糖是生产补钙剂葡萄糖酸钙的原料
C. 苯是煤干馏或石油分馏的主要产品之一
D. 乙醇、乙酸均可与钠、氢氧化钠发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.01 molNH4Cl和0.005mol NaOH溶于水配成1 L 溶液(Ph>7).
(1)该溶液中存在的三个平衡体系是: __ _____、__ ____、_____________。
(2)溶液中存在的离子物质的量浓度由大到小顺序为 。
(3)这些粒子中浓度为0.01 mol/L 的是_________,浓度为0.005 mol/L 的是_________。
(4)物质的量之和为0.01 mol的两种粒子是:_________________________。
(5)NH4+和H+两种离子数量之和比OH-多_______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊五种物质中,甲、乙、丙均含有相同的某种元素,丁是一种常见气体单质,它们之间具有如图所示转化关系。下列有关物质的推断不正确的是
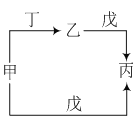
A.若甲为Na,则戊可能是H2O
B.若甲为C2H4,则戊可能是O2
C.若甲为NO,则戊可能是H2O
D.若甲为Cl2,则戊可能是NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为回收利用废钒催化剂(含有V205、V0S04及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如下:

部分含钒物质常温时在水中的溶解性如下:

回答下列问题:
(1)废钒催化剂,粉碎的目的是 ,V0S04溶液水解显酸性,离子方程式为
(2)工业上由V2O5冶炼金属钒常用铝热法,该反应的化学方程式为 引发铝热反应的操作是:在纸漏斗中加入铝热剂后,再
(3)为了提高钒的浸出率,反应①用Na2SO3和硫酸酸浸使催化剂中的V2O5转变成可溶于水的V0S04,与水浸液合并,再通过反应②用KClO3氧化,使+4价的V氧化成易溶于水的(VO2)2SO4反应①的离子方程式为
(4)该工艺中反应③的沉淀率是回收钒的关键之一,该步反应的离子方程式为 。
(5)已知常温下NH4VO3的溶解度为0.468g/100g水,则NH4VO3的溶度积常数约为 (已知V的相对原子质量为51)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com