
| 1.2mol |
| 2mol |
| 0.8mol |
| 2.5l |
| 0.6mol |
| 2.5L |
| 0.6mol |
| 2.5L |
| 1.2mol |
| 2mol |
| 0.8mol |
| 2.5l |
| 0.6mol |
| 2.5L |
| 0.6mol |
| 2.5L |
| 0.24mol/L×0.24mol/L |
| (0.32mol/L)2 |


科目:高中化学 来源: 题型:
| A、碳酸钠固体 |
| B、把稀硫酸改为浓硫酸 |
| C、硫酸钾稀溶液 |
| D、铜粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、高温下进行的反应都是吸热反应,常温下能够进行的反应都是放热反应 |
| B、实验室用4mol SO2与2mol O2进行下列反应:2SO2(g)+O2(g)?2SO3(g)△H=-196.64kJ/mol,当放出314.624kJ热量时,SO2的转化率为80% |
| C、常温下,向纯水中通入一定量二氧化硫,则水的电离平衡被促进 |
| D、向3mL0.1mol/LAgNO3溶液中滴入5滴0.1mol/L NaCl溶液产生白色沉淀,再滴入KI稀溶液沉淀显黄色,则KSP(AgI)<KSP(AgCl) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在任何温度下都能自发进行 |
| B、在任何温度下都不能自发进行 |
| C、仅在高温下自发进行 |
| D、仅在低温下自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某种液体的饱和蒸气压与温度有关 |
| B、物体内所有分子热运动动能的总和就是物体的内能 |
| C、气体的温度升高,每个分子的动能都增大 |
| D、不是所有晶体都具有各向异性的特点 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在含有Fe(SCN)3的红色溶液中加入3~5滴NaOH稀溶液,振荡静置,混合溶液颜色变浅 |
| B、把盛有NO2(g)、N2O4(g)组成的平衡体系的容器放入到热水中,混合气体的颜色加深 |
| C、反应2NO2(g)═O2(g)+2NO(g)△H<0,达到平衡后,减小压强混合气体颜色变浅 |
| D、使用催化剂可加快SO2转化为SO3的速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
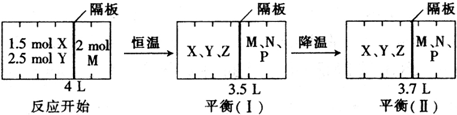
| A、若增大压强,则物质Y的转化率减小 | ||
B、将容器体积变为20 L,Z的平衡浓度变为原来的
| ||
| C、以X的浓度变化表示的反应速率为0.001 mol/(L?s) | ||
| D、若升高温度,X的体积分数增大,则该反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com