
【题目】以铁片和铜片为两极,以稀硫酸为电解质溶液组成原电池,当导线中通过2mol电子时,下列说法正确的是( )
A. 铁片溶解1 mol,铜片上析出1 mol H2
B. 两极上溶解和析出的物质的质量相等
C. 铁片溶解2 g,铜片上析出1 g H2
D. 铁片溶解1 mol,转移电子1 mol
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】某化学小组采用如图所示装置,对浓硝酸与木炭的反应进行探究(已知:4HNO34NO2↑+O2↑+2H2O)。

请回答下列问题:
(1)检查装置气密性后,将燃烧匙中的木炭在酒精灯上加热至红热状态,伸入三口烧瓶中,并塞紧瓶塞,滴加浓硝酸,可观察到三口烧瓶中气体的颜色为________,产生该气体的化学方程式是____________。
(2)装置C中盛有足量Ba(OH)2溶液,炽热的木炭与浓硝酸反应后可观察到C中出现白色沉淀,该白色沉淀为____________(填化学式)。
(3)装置B的作用是__________________________。
(4)装置D中收集到了无色气体,部分同学认为是NO,还有部分同学认为是O2。
①下列对该气体的检验方法合适的是________。
A.敞口观察装置D中集气瓶内气体的颜色变化
B.将湿润的蓝色石蕊试纸伸入集气瓶内,观察蓝色石蕊试纸是否变红
C.将带火星的木条伸入集气瓶中,观察木条是否复燃
②如果D中集气瓶中收集的无色气体是氧气,则氧气的来源是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】增塑剂DCHP可由环己醇制得。DCHP和环己醇的结构简式如图所示,下列说法错误的是( )
![]()
环己醇
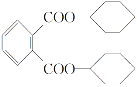
DCHP
A. DCHP的分子式为C20H26O4
B. 环己醇分子中所有碳原子不可能共平面
C. DCHP的一氯取代物有5种
D. DCHP通过取代反应可以得到环己醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应能量的说法正确的是
A. 若反应A=B △H<0,说明A物质比B物质稳定,分子内共价键键能 A比B大
B. 500 ℃、30 Mpa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g), 放热 akJ,热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H= -2a kJmol-1
2NH3(g) △H= -2a kJmol-1
C. 101kPa时,2H2(g)+O2(g)==2H2O(g);△H=-QkJ·mol-1,则H2的燃烧热为1/2QkJ·mol-l
D. 化学反应中,吸热反应不一定需要加热也能发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电浮选凝聚法处理酸性污水的工作原理如图所示。下列说法不正确的是( )
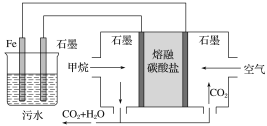
A. 铁电极的电极反应式为Fe-2e-===Fe2+
B. 若左池石墨电极产生44.8 L(标准状况)气体,则消耗1.0 mol甲烷
C. 通入甲烷的石墨电极的电极反应式为CH4+4CO32--8e-===5CO2+2H2O
D. 为了增强污水的导电能力,可向污水中加入适量工业用食盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 0.5mol![]() 含中子数为8NA
含中子数为8NA
B. 常温下,1 mol NH4Cl含共价键数目为5NA
C. 足量的Cu与含溶质1mol的浓H2SO4反应,转移的电子数为NA
D. 标况下,22.4LNO和11.2LO2混合后的气体分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组设计以下三个实验探究氯水的组成,请根据下表回答问题。
实验序号 | 实验方法 | 实验现象 | 结论 |
① | 将氯水滴加到AgNO3溶液中 | a: | 氯水中含有Cl- |
② | 将氯水滴加到含酚酞的NaOH溶液中 | 红色溶液 变为无色 | …… |
③ | 将氯水滴加到Na2CO3溶液中 | b: | 氯水中含有H+ |
(1)写出实验①和③的实验现象。
a:________________,b:________________。
(2)有同学认为实验③产生的现象是因为氯水中含有次氯酸,你是否同意这个观点?________(填“同意”或“不同意”),理由是________________________________________________。
(3)在分析实验②中实验现象产生的原因时,同学们的意见出现了分歧。甲同学认为氯水加到NaOH溶液中发生了中和反应而使溶液退色,乙同学认为氯水中含有的次氯酸具有漂白性而使溶液褪色。请你设计简单的实验证明他们的观点:______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,mg下列物质在足量的氧气中充分燃烧后,产物与足量的过氧化钠充分反应,过氧化钠增加了ng,且n>m,符合此要求的物质是( )
①H2 ②HCHO ③CH4 ④HCOOCH3⑤CH3CHO
A. ①② B. ③⑤ C. ①②③④⑤ D. ④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一新型、高效、无毒的多功能水处理剂。
(资料)K2FeO4为紫色固体,微溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4。
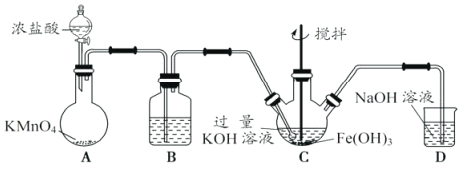
①A为制取氯气发生装置,其中盛放浓盐酸的仪器名称为___________。
②除杂装置B中的试剂为___________。
③C为制备K2FeO4装置,KOH溶液过量的原因是___________。
④D为尾气处理装置,发生反应的离子方程式为___________。
(2)探究 K2FeO4的性质。取C中紫色溶液,加入稀硫酸,产生黃绿色气体,得溶液a,经检验气体中含有Cl2。为证明K2FeO4能否氧化Cl-而产生Cl2,设计以下方案:
方案I | 取少量溶液a,滴加KSCN溶液至过量,溶液呈红色。 |
方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
①由方案I中溶液变红可知a中含有___________。该离子的产生___________(填“能”或“不能”)判断一定是由K2FeO4被Cl-还原而形成的。
②方案Ⅱ用KOH溶液洗涤的目的是___________。方案Ⅱ得出氧化性:Cl2___________FeO42-(填“>”或“<”)
(3)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。K2FeO4在硫酸溶液中反应如下:_______ FeO42-+______H+===_______O2↑+________Fe3++________(配平及完成上述离子方程式)________。现取C中洗涤并干燥后样品的质量10g,加入稀硫酸,收集到0.672L气体(标准状况下)。则样品中高铁酸钾的质量分数约为___________。(计算结果保留到0.1%)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com