
| 时间/min 浓度 物质 | 0 | 1 | 2 | 3 | 4 |
| CH4 | 0.2mol•L-1 | 0.13mol•L-1 | 0.1mol•L-1 | 0.1mol•L-1 | 0.09mol•L-1 |
| H2 | 0mol•L-1 | 0.2mol•L-1 | 0.3mol•L-1 | 0.3mol•L-1 | 0.33mol•L-1 |
分析 (1)根据燃烧热写出热化学方程式,利用盖斯定律计算;
(2)①反应方程式为CH4(g)+H2O(g)=CO(g)+3H2(g)根据三行式代入平衡常数表达式进行计算;
②根据表中数据可知3min时达到平衡,再根据4min时各组分浓度变化量判断改变的条件;
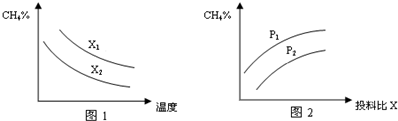
(3)①碳水比n(CH4)/n(H2O)值越大,平衡时甲烷的转化率越低,含量越高;
②根据压强对平衡移动影响,结合图象分析解答;
(4)①甲烷燃料电池工作时,负极发生氧化反应,甲烷失电子被氧化反应;
②计算氧气的物质的量,进而计算生成二氧化碳的物质的量,根据n(KOH)与n(CO2)比例关系判断反应产物,进而计算溶液中电解质物质的量,结合盐类水解与电离等判断离子浓度大小.
解答 解:(1)已知:①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g) )△H=-283.0kJ•mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(l))△H=-890.3kJ•mol-1,
④H2O(g)=H2O(l)△H=-44.0kJ•mol-1,
利用盖斯定律将④+③-②-3×①可得:CH4(g)+H2O(g)=CO(g)+3H2(g)
△H=(-44.0kJ•mol-1)+(-890.3kJ•mol-1)-(-283.0kJ•mol-1)-3×(-285.8kJ•mol-1)=+206.1 kJ•mol-1,
故答案为:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ/mol;
(2)①反应方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g),
初起量(mol•L-1):0.2 0.3 0 0
变化量(mol•L-1):0.1 0.1 0.1 0.3
平衡量(mol•L-1):0.1 0.2 0.1 0.3
所以K=$\frac{c(CO)•{c}^{3}({H}_{2})}{c(C{H}_{4})•c({H}_{2}O)}$=$\frac{0.1×0.{3}^{3}}{0.1×0.2}$=0.135,故答案为:0.135;
②3min时改变的反应条件,反应向正反应方向进行,可能为升高温度或增大H2O的浓度或减小CO的浓度,
故答案为:升高温度或增大H2O的浓度或减小CO的浓度;
(3)①碳水比n(CH4)/n(H2O)值越大,平衡时甲烷的转化率越低,含量越高,故x1>x2,故答案为:>;
②该反应正反应是气体体积增大的反应,增大压强平衡向逆反应方向移动,平衡时甲烷的含量增大,故p1>p2,故答案为:>;
(4)①甲烷燃料电池工作时,负极发生氧化反应,甲烷失电子被氧化反应,负极电极反应式为CH4-8e-+10OH-=CO32-+7H2O,故答案为:CH4-8e-+10OH-=CO32-+7H2O;
②KHCO3溶液中碳酸氢根离子的水解程度大于其电离程度,所以溶液显示碱性,则该溶液中各离子浓度由大到小的关系为,故c(K+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-),
故答案为:c(K+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-).
点评 本题综合性较大,涉及化学平衡图象、化学平衡的影响因素、化学平衡计算、原电池、化学计算、离子浓度比较等,为高考常见题型,难度中等,是对基础知识与学生能力的综合考查,注意把握化学平衡的影响因素以及图象、数据的分析能力的培养.


科目:高中化学 来源: 题型:选择题
| A. | 参加反应物质的性质是决定化学反应速率的主要因素 | |
| B. | 光是影响某些化学反应速率的外界条件之一 | |
| C. | 决定化学反应速率的主要因素是浓度 | |
| D. | 增大浓度、加热、加压或使用催化剂,都是加快反应速率的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
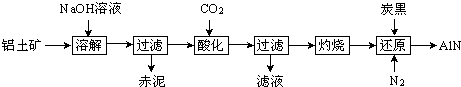
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 加入氮化铝样品的质量/g | 4.1 | 8.2 | 12.3 |
| 生成氨气的体积/L(标准状况) | 1.456 | 2.912 | 4.256 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有机化合物中只存在极性键 | |
| B. | 碳原子最外层有4个电子,在形成化合物时必须与4个原子结合 | |
| C. | 碳原子间可形成非极性键 | |
| D. | 碳原子易失去或获得电子而形成阳离子或阴离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可将固体或浓溶液直接在容量瓶中溶解或稀释 | |
| B. | 氯化钠溶解于水,形成能够自由移动的水合钠离子和水合氯离子 | |
| C. | 失去电子越多的氧化剂,其氧化性就越强 | |
| D. | 物质的量浓度相等的盐酸和醋酸,导电能力相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M+2Q | B. | M+4Q | C. | 2Q | D. | 2M+2Q |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
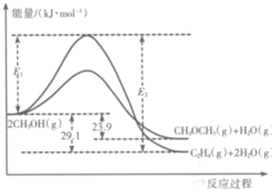
起始投料/mol 编号 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
| 恒温容器1 | 2 | 0 | 0 |
| 恒温容器2 | 0 | 2 | 2 |
| 绝热容器3 | 2 | 0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
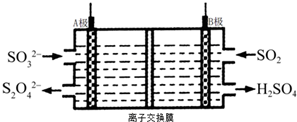
| A. | A电极接电源的正极 | |
| B. | A极区溶液的碱性逐渐增强 | |
| C. | 本装置中使用的是阴离子交换膜 | |
| D. | B极的电极反应式为SO2+2e-+2H2O═SO42-+4H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com