
【题目】某课外探究活动小组使用常用仪器,运用实验室制备氢气的原理,巧妙设计了如图所示的简单实验装置。

甲同学设计了如图甲所示装置:
①检查该装置气密性的方法是_________
②实验时若液面不能与锌粒接触,又无酸液可加,且该装置已固定,则使反应发生的操作是_____
(2)乙同学把试管底部钻一小洞,并和广口瓶组装成如图乙所示具有启普发生器功能的装置,若该装置中的隔板是用铜丝制成的,隔板上放锌粒,酸使用H2SO4,写出反应的离子方程式:_____
(3)丙同学设计了如图丙所示装置,即用橡皮塞代替铁架台来固定试管,则丙同学的做法________(填“可行”或“不可行”),理由是______________
【答案】关闭活塞,从长颈漏斗向U形管中加水,若长颈漏斗中形成一段稳定的水柱,说明装置气密性良好 从长颈漏斗加入少量蒸馏水使溶液与锌粒接触 Zn+2H+=Zn2++H2↑ 不可行 广口瓶被橡皮塞密封后,瓶内的气压会随液体的加入而增大,使试管中的液体不能在关闭阀门时排入广口瓶中,因而不能使反应随时停止,甚至会由于容器中气压过高而发生危险
【解析】
(1)①设法使装置内外形成气压差是气密性检查的常用手段,据此分析;
②根据实验时若液面刚好不与锌粒接触,而又无酸液,且该装置已固定,可以加蒸馏水使酸和锌接触分析;
(2)锌和稀硫酸反应生成硫酸锌与氢气;
(3)根据能否造成安全事故分析判断,如果容器内压强过大,会造成安全事故。
(1)①气密性检验的方法是:关闭活塞,从长颈漏斗向U形管中加水,若长颈漏斗中形成一段稳定的水柱,说明装置气密性良好;
②实验时若液面刚好不与锌粒接触,而又无酸液可加,且该装置已固定,可以加蒸馏水使酸和锌接触,即从长颈漏斗加入少量蒸馏水使溶液与锌粒接触;
(2)锌粒会与稀硫酸反应,其离子方程式为:Zn+2H+=Zn2++H2↑;
(3)由于广口瓶被橡皮塞密封后,瓶内的气压会随液体的加入而增大,使试管中的液体不能在关闭阀门时排入广口瓶中,因而不能使反应随时停止,甚至会由于容器中气压过高而发生危险,所以该做法不可行,故答案为:不可行;广口瓶被橡皮塞密封后,瓶内的气压会随液体的加入而增大,使试管中的液体不能在关闭阀门时排入广口瓶中,因而不能使反应随时停止,甚至会由于容器中气压过高而发生危险。


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 1mol H2SO4的质量为98g/mol
B. 水的摩尓质量是18g
C. 物质的量既可以表示物质的数量,又可以表示物质的质量
D. 23g金属钠中含有的电子的物质的量为11mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃分子中若含有双键,叁键或环,其碳原子所结合的氢原子则少于同碳原子数对应烷烃所含的氢原子数,亦具有一定的不饱和度(用W表示)。下表列出几种烃的不饱和度:
有机物 | 乙烯 | 乙炔 | 环己烷 | 苯 |
W | 1 | 2 | 1 | 4 |
据此下列说法不正确的是
A. 1molW=3的不饱和链烃再结合6molH即达到饱和
B. ![]() 的W等于6
的W等于6
C. CH3CH2CH=CH2与环丁烷的不饱和度相同
D. C4H8的不饱和度与C3H6、C2H4的不饱和度不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应能设计成原电池的是( )
A.CaCO3+2HCl═CaCl2+H2O+CO2↑B.BaCl2+Na2SO4═2NaCl+BaSO4↓
C.2NaOH+CO2═Na2CO3+H2OD.Fe+CuCl2═FeCl2+Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 某物质在熔融态下能导电,则该物质中一定含有离子键
B. ![]() 中既有离子键又有共价键,所以
中既有离子键又有共价键,所以![]() 属于离子化合物
属于离子化合物
C. ![]() 和
和![]() 两种分子中,每个原子的最外层都具有8电子稳定结构
两种分子中,每个原子的最外层都具有8电子稳定结构
D. 二氧化硅和干冰都是共价化合物,其溶于水的过程中均只需克服分子间作用力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)已知某反应中能量变化如图所示,所得结论错误的是( )

A. 该图像可以表示氯化铵与消石灰反应的能量变化
B. 该反应过程中,一定有其他形式的能量转化成化学能
C. 该反应过程中,形成新化学键释放的总能量小于断裂旧化学键吸收的总能量
D. 因为生成物的总能量高于反应物的总能量,所以该反应一定需要加热才可进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一体积为2L的密闭容器中充入2mol X,一定条件下可发生反应:2X(g)![]() 3Y(g),该反应的反应速率(v)与时间(t)的关系如图所示,已知
3Y(g),该反应的反应速率(v)与时间(t)的关系如图所示,已知![]() min时容器内有1.5mol Y。下列叙述正确的是( )
min时容器内有1.5mol Y。下列叙述正确的是( )

A. 若![]() min时升高温度,则反应速率不变
min时升高温度,则反应速率不变
B. ![]() ~
~![]() min内,
min内,![]() ,反应不再发生
,反应不再发生
C. 0~![]() min内,
min内,![]()
D. ![]() min时,只有正反应发生
min时,只有正反应发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一。请回答钢铁在腐蚀、防护过程中的有关问题。
(1)下列哪个装置可防止铁棒被腐蚀________________。
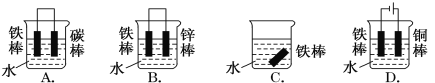
(2)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如图。请回答:
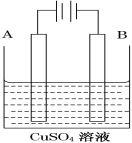
①A电极对应的金属是________(写元素名称),
B电极的电极反应式是___________________________________。
②若电镀前A、B两金属片质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12 g,则电镀时电路中通过的电子为________mol。
③镀层破损后,不易被腐蚀的是___________(填A或B)。
A.镀铜铁 B.镀锌铁 C. 镀锡铁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com