
【题目】(1)写出表示含有8个质子,10个中子的原子的化学符号:__________。
(2)根据下列微粒回答问题:![]() 、
、![]() 、
、![]() 、14C、14N、16O、35Cl2、37Cl2。
、14C、14N、16O、35Cl2、37Cl2。
①以上8种微粒共有________种核素,共_________种元素。
②互为同位素的是________________。
③质量数相等的是_________和_________,中子数相等的是_______和_________。
(3)相同物质的量的14CO2与S18O2的质量之比为_________;中子数之比为_______;电子数之比为________。
(4)铷和另一种碱金属形成的合金7.8 g与足量的水反应后,产生0.2 g氢气,则此合金中另一碱金属可能是:________________。(铷的相对原子量取85.5)
(5)质量相同的H2O和D2O与足量钠反应,放出的气体在标况下的体积之比为________。
【答案】![]() 6种核素 5种元素
6种核素 5种元素 ![]() 、
、![]() 、
、![]() 14C 14N 14C 16O 23:34 2:3 11:16 Li或Na 10 : 9
14C 14N 14C 16O 23:34 2:3 11:16 Li或Na 10 : 9
【解析】
(1)含有8个质子,10个中子的原子的化学符号是![]() ;
;
(2)①核素是具有一定数目的质子和一定数目的中子的原子,在以上8种微粒有11H、21H、31H、14C、14N、16O,共6种核素;由于质子数相同的微粒属于同一种元素,则共H、C、N、O、Cl5种元素;②质子数相同而中子数不同的原子互成同位素,属于同位素的是11H、21H、31H;③在原子符号左上角表示的是质量数,质量数相等的是4C和14N;中子数在质量数与质子数的差,则中子数相等的是14C和16O,二者的中子数都是8个;
(3)相同物质的量的14CO2与S18O2的质量之比为(14+32):(32+36) =23:34;中子数之比是2:3;电子数之比为11:16;
(4) 0.2g氢气的物质的量为n(H2)= 0.2g÷2g/mol=0.1mol,则根据方程式可知金属与氢气的物质的量的比是1:1,则合金的平均摩尔质量为:M=7.8g÷0.2mol=39g/mol,铷的相对原子量取85.5,则铷的摩尔质量为85.5g/mol,则另一种碱金属的摩尔质量一定小于39g/mol,故另一碱金属可能是Li或Na;
(5) 质量相同的H2O和D2O的物质的量之比为n(H2O):n(D2O)=1/18:1/20=10:9,由2Na+2H2O =2NaOH+H2↑、2Na+2D2O =2NaOD+ D2↑,可知H2、D2的物质的量之比等于H2O和D2O的物质的量之比,即H2和D2的物质的量之比为10:9,根据n=V/Vm可知,相同体积气体体积之比等于其物质的量之比,故H2和D2的体积之比为10:9。


科目:高中化学 来源: 题型:
【题目】为保持街道整洁、湿润,在路面或广场上喷洒含化学式为XY2的溶液作保湿剂。X原子的结构示意图为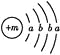 ,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
(1)m= ,该保湿剂的化学式为
(2)Z、W元素的名称为 、
(3)下列说法中正确的是
A.XY2和WZ2都为离子化合物
B.XY2中仅含离子键,WZ2中仅含极性共价键
C.H2Z比HY的稳定性强
D.X的阳离子比Y的阴离子半径大
(4)下列化学用语表达正确的是
A.XY2的电子式:X2+![]()
B.WZ2的结构式:Z=W=Z
C.Y元素的单质与H2Z水溶液反应的离子方程式为:Y2+Z2-2Y-+Z↓
D.用电子式表示XY2的形成过程为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
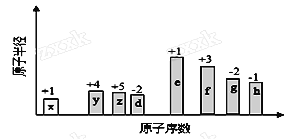
根据判断出的元素回答问题:
(1)f在元素周期表的位置是__________。
(2)比较d、e常见离子的半径的大小(用化学式表示,下同)_______>__________;比较g、h的最高价氧化物对应的水化物的酸性强弱是:_______>__________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式__________。
(4)已知1mole的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非物质文化遗产“芜湖铁画”的某些产品中含有铁、金和碳等成分(其他成分忽略不计)。某同学取一定质量的铁画废弃样品,加入100mL稀盐酸中,恰好完全反应,放出0.3gH2,剩余固体质量为0.1g。请计算:
(1)样品中铁的质量分数。
(2)稀盐酸的物质的量浓度。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有色金属行业发展蕴藏着巨大潜力。目前,全世界消费量排在前五位为铜、铝、铅、锌、镍。
(1)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于___晶体;基态Ni原子的价电子电子排布式为____。
(2)铜原子的电子占有____种能量不同的原子轨道。
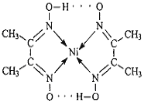
(3)配合物分子内(如图)的作用力有_____(填编号)。
A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
(4)很多不饱和有机物在Ni催化下可以与H2发生加成反应。如 ①CH2=CH2、②CH≡CH、③![]() 、④HCHO等,其中分子中C原子为SP2杂化的有____(填物质序号),预测HCHO分子的立体结构为_____形。
、④HCHO等,其中分子中C原子为SP2杂化的有____(填物质序号),预测HCHO分子的立体结构为_____形。
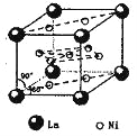
(5)氢气是新型清洁能源,镧(La)和镍(Ni)的合金可做储氢材料。该合金的晶胞如右图所示,晶胞中心有一个镍原子,其他镍原子都在晶胞面上,镧原子都在晶胞顶点上。该晶体的化学式为______。
(6)邻羟基苯甲醛的沸点____(填大于,小于或等于)对羟基苯甲醛的沸点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于![]() 的说法正确的是
的说法正确的是
A. 所有碳原子可能共平面 B. 除苯环外的碳原子共直线
C. 最多只有4个碳原子共平面 D. 最多只有3个碳原子共直线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度是2.18g/cm3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验中可以用下图所示装置制备1,2-二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有浓溴水(表面覆盖少量水)。请填写下列空白:
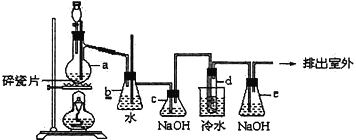
(1)图中碎瓷片的作用是_________________________,若在反应过程中发现未加碎瓷片,应该_____________________________。
(2)烧瓶a中温度计的作用是___________________,该反应是乙醇的脱水反应,即消去反应,反应温度是170℃,并且该反应要求温度迅速高到170℃,否则容易产生副反应。请你写出该副反应的反应方程式:_______________________________。
(3)写出制备1, 2-二溴乙烷的化学方程式:_______________________________。
(4)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象:_______________________________。
(5)容器c中NaOH溶液的作用是:_______________________________。
(6)某学生做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超出许多,如果装置的气密性没有问题,试分析其可能的原因_________________________。
(7)e装置内NaOH溶液的作用是_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2 L密闭容器中充入4 mol A气体和3 mol B气体,发生下列反应:2A(g)+B(g)![]() C(g)+xD(g),5 s达到平衡。达到平衡时,生成了1 mol C,测定D的浓度为1 mol·L-1。
C(g)+xD(g),5 s达到平衡。达到平衡时,生成了1 mol C,测定D的浓度为1 mol·L-1。
(1)求x=_____。
(2)求这段时间A的平均反应速率为_____。
(3)平衡时A的转化率为_____。
(4)下列叙述能说明上述反应达到平衡状态的是_____
A. 单位时间内每消耗2 mol A,同时生成1 mol C
B. 单位时间内每生成1 molB,同时生成1 molC
C. D的体积分数不再变化
D. 混合气体的压强不再变化
E. B、C 的浓度之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量浓度均为0.1 mol/L的盐酸和醋酸溶液,下列说法正确的是( )
A. 两溶液加入等质量的锌粉,产生氢气的速率相同
B. 两溶液中氢氧根离子浓度均为![]()
C. 加入醋酸钠固体,二者的pH均增大
D. 恰好完全反应时,两溶液消耗等浓度等体积的氢氧化钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com