
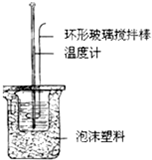
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NaC1与Na2CO3灼烧时火焰颜色相同 |
| B.所有金属及其化合物灼烧时火焰均有颜色 |
| C.非金属单质燃烧时火焰均为无色 |
| D.焰色反应只能在物质发生物理变化过程中呈现出来 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.某物质灼烧时,焰色反应为黄色,该物质一定是钠的化合物 |
| B.用酒精萃取碘水中的碘 |
| C.称量NaOH固体时,将NaOH固体放在托盘天平左盘的纸上 |
| D.蒸馏时,应将温度计水银球靠近蒸馏烧瓶的支管口附近 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
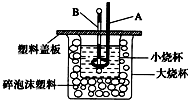
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L盐酸的体积(mL) | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 滴定次数 | 待测草酸溶液体积(mL) | 0.1000mol/LKMnO4标准溶液体积(mL) | |
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 25.00 | 0.00 | 10.02 |
| 第二次 | 25.00 | 0.22 | 11.32 |
| 第三次 | 25.00 | 1.56 | 11.54 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com