
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电
电压,高铁电池的总反应为


下列叙述不正确的是
A.充电时阳极反应为: |
B.放电时负极反应为: |
| C.放电时每转移3mol电子,正极有1molK2FeO4被氧化 |
| D.放电时正极附近溶液的碱性增强 |
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:实验题
菱镁矿是碱性耐火材料的主要原料,其主要的化学成分是:MgCO3,同时含有杂质:SiO2、Al2O3、Fe2O3、CaO等;目前以菱镁矿为主要原料制备MgSO4的方法如下:
已知:①常温下,Fe3+、Al3+、Mg2+开始形成氢氧化物沉淀和沉淀完全时的pH值如下:
| | Fe3+ | Al3+ | Mg2+ |
| 开始沉淀 | 2.1 | 3.7 | 9.0 |
| 沉淀完全 | 3.2 | 5.2 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列防腐措施中,利用原电池反应使主要金属得到保护的是( )
| A.用氧化剂使金属表面生成致密稳定的氧化物保护膜 |
| B.在金属中加入一些铬或镍制成合金 |
| C.在轮船的壳体水线以下部分装上锌锭 |
| D.金属表面喷漆 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在25ºC时,将两根铂电极插入一定量的硫酸钠饱和溶液中进行电解,当电路中有a mol电子转移时,溶液中析出mg Na2SO4 ·10 H2 O晶体。若温度不变,在剩余溶液中溶质的质量分数为
A.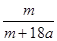 ×100% ×100% | B. ×100% ×100% |
C. ×100% ×100% | D.71m/161(m+9a) ×100% |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一种氢氧燃料电池用30%KOH溶液为电解质溶液,有关这种电池的说法中错误的是
| A.H2在负极发生氧化反应 | B.供电时的总反应为:2H2 + O2 = 2H2O |
| C.产物为无污染的水,属于环境友好电池 | D.负极反应为:H2 - 2e- = 2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
利用电解法可将含有Fe、Zn、Ag、Pt等杂质的粗铜提纯,下列叙述正确的是
| A.电解时以精铜作阳极 |
| B.电解时阴极发生还原反应 |
| C.粗铜连接电源负极,其电极反应是Cu =Cu2+ + 2e- |
| D.电解结束,电解槽底部会形成含少量Ag、Pt等金属的阳极泥 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
据报道,美国正在研究的锌电池可能取代目前广泛使用的铅蓄电池。锌电池具有容量大、污染少等优点。电池反应为2Zn+O2=2ZnO,原料为锌粒、电解液和空气。下列叙述正确的是
| A.锌为正极,空气进入负极反应 |
| B.负极反应为Zn+2OH--2e-=ZnO+H2O |
| C.正极发生氧化反应 |
| D.电解液肯定是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl。下列“水” 电池在海水中放电时的有关说法正确的是
| A.每生成1 mol Na2Mn5O10转移2 mol电子 | B.正极反应式:Ag+Cl--e-=AgCl |
| C.Na+不断向“水”电池的负极移动 | D.AgCl是还原产物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com