
【题目】正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子通过氢键相连(如图).下列有关说法正确的是( ) 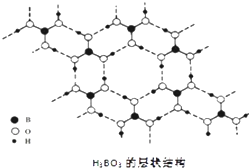
A.正硼酸晶体属于原子晶体
B.H3BO3分子的稳定性与氢键有关
C.分子中硼原子最外层为8e﹣稳定结构
D.含1mol H3BO3的晶体中有3mol氢键
【答案】D
【解析】解:A.正硼酸晶体中存在H3BO3分子,且该晶体中存在氢键,说明硼酸由分子构成,是分子晶体,原子晶体内只有共价键,故A错误.B.分子的稳定性与分子内的B﹣O、H﹣O共价键有关,熔沸点与氢键有关,故B错误.
C.硼原子最外层只有3个电子,与氧原子形成3对共用电子对,因此B原子不是8e﹣稳定结构,故C错误;
D.一个H3BO3分子对应着6个氢键,一个氢键对应着2个H3BO3分子,因此含有1 molH3BO3分子的晶体中有3mol氢键,故D正确;
故选D.
【考点精析】认真审题,首先需要了解晶体的类型与物质熔点、硬度、导电性等的关系(不同晶体类型的物质:原子晶体>离子晶体>分子晶体;同种晶体类型的物质:晶体内微粒间的作用力越大,溶、沸点越高).


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】新制氯水与久置的氯水相比较,下列结论不正确的是 ( )
A. 颜色相同 B. 前者能使有色布条褪色
C. 都含有H+ D. 加AgNO3溶液都能生成白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为了探究常温下某非金属氧化物形成的未知气体的成分,将气体通入澄清石灰水,发现澄清石灰水变浑浊,持续通入发现浑浊又变澄清,由此该小组成员对气体的成分提出猜想。
(1)[提出猜想]
猜想1:该气体为CO2。
猜想2:该气体为SO2。
猜想3:。
(2)为了验证猜测,该小组设计实验加以探究。
[实验探究]
该小组同学按如图所示装置,将气体从a端通入。
B中应该装下列________试剂(填编号)。
A.NaCl溶液
B.酸性KMnO4溶液
C.盐酸
D.澄清石灰水
(3)A中品红溶液的作用是。
(4)D中澄清石灰水的作用是。通过该实验,该小组同学观察到以下三个实验现象:
①A中品红溶液褪色 ②C中品红溶液不褪色 ③D中澄清石灰水变浑浊
(5)[得出结论]
由上述现象,该小组同学确认该气体的成分为:。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素有-3、0、+1、+2、+3、+4和+5七种化合价,试据此判断下列四种化合物:
①NO ②N2O4 ③HNO3 ④NH3
(1)氮元素只能作还原剂的是(填序号,下同)。
(2)可能是HNO2还原产物的是。
(3)已知CuO具有氧化性,能够和氨气反应生成两种单质,请写出在加热条件下CuO和NH3反应的化学方程式。。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一反应体系中有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中H2O2只发生如下过程:H2O2→O2。
(1)该反应中的还原剂是。
(2)该反应中,发生还原反应的过程是→。
(3)写出该反应的化学方程式,并用双线桥法标出电子转移的方向和数目:。
(4)若反应转移了0.3 mol电子,则产生的气体在标准状况下体积为L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组设计了如图装置证明和比较SO2和氯水的漂白性,其中B、D中为品红溶液,C中为NaOH溶液. 
(1)该化学兴趣小组同学为制取Cl2和SO2气体,现采用Na2SO3与70%的浓硫酸为原料制取SO2 , 采用MnO2和浓盐酸(12mol/L)为原料制取Cl2 . 请写出制取Cl2的离子方程式:
(2)反应开始后,发现B、D两个装置中的品红溶液都褪色,停止通气后,取B、D溶液于试管中分别加热,两个试管中的现象分别为:BD . 解释B中对应现象的原因 .
(3)装置C的作用是
(4)该实验小组的甲、乙两位同学利用上述两发生装置按下图装置继续进行实验: 
通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅.试根据该实验装置和两名同学的实验结果回答问题.
①两同学在气体进入品红溶液之前,先将气体通过F装置,F中可盛装浓硫酸.其目的是使SO2和Cl2混合均匀并且 .
②试分析甲同学实验过程中,品红溶液不褪色的原因是: . (用离子方程式说明)
③你认为乙同学是怎样做到让品红溶液变得越来越浅的? .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机化合物的同分异构体数目最多的是( )
A.分子式为C5H10O2的酯类
B.分子式为C5H10的烯烃
C.分子式为C5H12O的醇类
D.分子式为C5H12的所有化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)判断下列物质在相应条件下能否电离,并说明理由。
①液态HCl: , 理由:。
②熔融状态下的NaCl: , 理由:。
③高温熔化后的单质铁: , 理由:。
④固体KOH: , 理由:。
(2)写出下列物质在水溶液中的电离方程式。
HCl:;
H2SO4:;
Ca(OH)2:;
KOH:;
NH4NO3:;
KAl(SO4)2:。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的量浓度的相关说法中错误的是( )
A.将25gCuSO4.5H2O晶体加水配成100mL溶液,该溶液的物质的量浓度为1mol/L
B.将100mL5mol/L盐酸溶液在蒸发皿中蒸发至50mL溶液,物质的量浓度变为10mol/L
C.将10mL0.1mol/LNaCl溶液和90mL水混合,所得溶液物质的量浓度约为0.01mol/L
D.实验室要用容量瓶配制0.2mol/L的NaCl溶液950mL,应称量NaCl固体11.1g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com